
将1L含有0.4mol CuSO4和0.2mol NaCl的水溶液用惰性电极电解一段时间后,若在一个电极上得到0.3mol Cu,则:
求:(1)另一电极上析出气体(在标准状况下)的体积是多少?
(2)此时溶液的H+离子浓度是多少?(溶液体积变化不计)
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
右图是关于反应A2(g)+3B2(g)===2C(g)△H<0的平衡移动图形,影响平衡移动的原因是
A.升高温度,同时加压。
B.降低温度,同时减压
C.增大反应物浓度,同时使用催化剂;
D.增大反应物浓度,同时减小生成物浓度

查看答案和解析>>
科目:高中化学 来源: 题型:
(NH4)2Cr2O7是一种受热易分解的盐,在分解的过程中发生了氧化还原反应。下列各组对(NH4)2Cr2O7受热分解产物的判断,符合实际的是
A.CrO3 + NH3 + H2O B.Cr2O3 +NH3 + H2O
C.CrO3 + N2 + H2O D.Cr2O3 +N2+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是
A. Mg电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH增大
D. 溶液中Cl-向正极移动
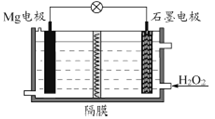
查看答案和解析>>
科目:高中化学 来源: 题型:
新型燃料逐渐取代传统燃料在工业生产和国防建设中广泛应用,回答下列问题:
(1)已知下列热化学方程式:
2H2(g)+O2(g)==2H2O(g) △H=-483.6 KJ.mol-1
H2O(l)==H2O(g) △H=+44 KJ.mol-1
则氢气的标准燃烧热 ▲ ,氢气热值 ▲ 。
(2)0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。写出该反应的热化学方程式 ▲ 。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4 (1) △H1= -195kJ·mol-1
② N2H4(1) + O2(g)= N2(g) + 2H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式 ▲ 。
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的电极反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是
A.16 gCH4与18 gNH4+ 所含质子数相等
B.CH4O和C2H6O都符合CnH2n+2O的通式,它们可能互为同系物
C.32S与33S的质子数相等,属于同一种元素的不同原子
D.质量相等、体积不等的N2和C2H4的分子数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
(1)③、④、⑦的原子半径由大到小的顺序为(用元素符号表示,下同) ▲ ;
(2)⑥和⑦的最高价含氧酸的酸性强弱为(用酸的化学式表示) ▲ ;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ▲ ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性.
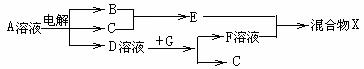
①写出D溶液与G反应的化学方程式: ▲ ;
②写出检验A溶液中溶质的阴离子的方法: ▲ ;
③常温下,若电解1L0.1mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为: ▲ ;
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有: ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的量的说法中正确的是( )
|
| A. | 物质的量是国际单位制中的七个基本物理量之一 |
|
| B. | 物质的量实质上就是物质的质量 |
|
| C. | 物质的量是一种物理量的单位 |
|
| D. | 摩尔既是物质的量的单位,又是粒子数量的单位 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com