
某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,某研究性学习小组欲分析其成分,实验记录如下图所示。
(1)该矿石中含有 (填化学式),请写出实验过程①中反应的离子方程式 。
(2)将氧化物Ⅱ在熔融状态下电解,可以得到某金属单质。当阳极上收集到气体33.6L(已折算成标准状况)时,阴极上得到该金属 g。
(3)试写出该金属与氧化物I反应的化学方程式 ;将该反应的产物加入到足量烧碱溶液中,请写出发生反应的离子方程式 。
(4)经进一步分析该矿石中还含有微量的SrCO3(上述方案检测不出)。锶(Sr)为第五周期ⅡA族元素。下列叙述正确的是 (填序号)。
①氯化锶(SrCl2)溶液显酸性
②SrSO4难溶于水
③工业上可以用电解SrCl2的水溶液制取金属锶(Sr)
④高纯六水氯化锶晶体(SrCl2·6H2O)必须在HCl氛围中加热才能得到SrCl2
(1)FeCO3、SiO2、Al2O3(3分,少一种或多一种扣1分);
H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓、Al3++4OH-=AlO2-+2H2O;(3分,每个1分)
(2)54(2分);
(3)2Al+Fe2O3 Al2O3+2Fe(2分);Al2O3+2OH-+2H2O=2[Al(OH)4]-或Al2O3+2OH-=2AlO2-+H2O(2分);
Al2O3+2Fe(2分);Al2O3+2OH-+2H2O=2[Al(OH)4]-或Al2O3+2OH-=2AlO2-+H2O(2分);
(4)②(2分)
解析试题分析:矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,加盐酸生成气体为二氧化碳,则一定含FeCO3;加盐酸后的滤渣为SiO2,胶状沉淀为硅酸;结合转化关系可知,滤液中含氯化亚铁、氯化铝、盐酸,反应①中加足量碱,生成白色沉淀为Fe(OH)2,红褐色沉淀为Fe(OH)3,则氧化物I为Fe2O3;无色滤液中含NaAlO2,通二氧化碳生成的白色沉淀为Al(OH)3,则氧化物II为Al2O3,然后结合单质、化合物的性质及化学用语来解答。
(1)由上述分析可知,矿石中含FeCO3、SiO2、Al2O3,①中反应的离子方程式为H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓、Al3++4OH-=AlO2-+2H2O;
(2)由4Al~3O2↑可知,阳极上收集到气体33.6L(已折算成标准状况)时,阴极上得到该金属为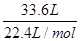 ×
× ×27g/mol=54g,故答案为:54;
×27g/mol=54g,故答案为:54;
(3)金属与氧化物I反应的化学方程式为2Al+Fe2O3 Al2O3+2Fe,该反应的产物加入到足量烧碱溶液中,氧化铝与碱反应的离子方程式为Al2O3+2OH-+2H2O=2[Al(OH)4]-或Al2O3+2OH-=2AlO2-+H2O
Al2O3+2Fe,该反应的产物加入到足量烧碱溶液中,氧化铝与碱反应的离子方程式为Al2O3+2OH-+2H2O=2[Al(OH)4]-或Al2O3+2OH-=2AlO2-+H2O
(4)锶(Sr)为第五周期ⅡA族元素,由同主族元素性质的相似性可知,
①氯化锶(SrCl2)溶液,为强碱强酸盐溶液,显中性,故错误;
②由硫酸钡难溶于水,则SrSO4难溶于水,故正确;
③工业上可以用电解SrCl2的水溶液,金属阳离子不能得到电子,所以不能制取金属锶(Sr),故错误;
④高纯六水氯化锶晶体(SrCl2?6H2O)加热才能得到SrCl2,不存在水解,故错误;
故答案为:②。
考点:考查探究物质的组成或测量物质的含量;物质分离和提纯的方法和基本操作综合应用;物质的检验和鉴别的基本方法选择及应用.。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.电解、电镀、电化学腐蚀都需要通电才可进行 |
| B.Al、Fe、Cu三者对应的氧化物均为碱性氧化物 |
| C.浓H2SO4和新制氯水分别滴在pH试纸上均会出现先变红后褪色的现象 |
| D.从石油中得到汽油,可采用分馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列叙述正确的是______________。
①SO2、NO、NO2都是形成酸雨的因素,都能和水反应生成酸
②除去CO2中少量的SO2,将混合气体通过饱和Na2CO3溶液
③水晶的主要成分是SiO2
④SiO2与CO2都属于酸性氧化物,都不能与酸反应
⑤将CO2通入饱和Na2CO3溶液中有沉淀产生,继续通入CO2沉淀溶解
⑥某酸雨样本采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
⑦CO2不能与CaCl2溶液反应,SO2也不能与CaCl2溶液反应
⑧实验室可用NaOH溶液处理NO2和SO2废气
⑨用稀双氧水清洗伤口可以杀菌消毒
⑩NO只能用排水集气法收集,不能用排空气法收集;而NO2只能用排空气法收集,不能用排水集气法
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据要求完成下列各小题
(1)①实验室用加热固体混合物的方法制备氨气的化学反应方程式是 。
②为了得到干燥的NH3,用________做干燥剂。(填编号)
| A.碱石灰 | B.浓H2SO4 | C.无水CaCl2 | D.P2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)写出工业用纯碱、石灰石、石英制普通玻璃的化学方程式 ; 。
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。原因是 (用化学方程式表式)
(3)向100ml水中投入Na和Al共16克,充分反应后分析剩余金属1g。计算放出H2的体积为 升(标准状况下)
(4)向含有0.3mol的NaAlO2溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为 mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120 ml 2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120 ml) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):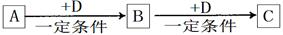
试回答:
(1)若D是具有氧化性的单质,则属于短周期的主族金属元素A为 (填元素符号)。
(2)若D是金属单质,D在潮湿的空气中易发生吸氧腐蚀,C溶液在保存时应加入酸和少量D防止其变质,若不加D则C溶液在空气中变质的离子方程式为 ;将D的氯化物的水溶液蒸干并灼烧产物是 。
(3)若A、B、C均为无机化合物,且均含地壳中含量最高的金属元素E,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式 。
(4)将第(1)题推出的A单质与第(3)题E单质的混合物11.9g投入一定量的水中充分反应,A与E均没有剩余,共收集到标准状况下的气体vL。向所得溶液中逐滴加入浓度为2mol?L-1的H2SO4溶液,至100mL时白色沉淀达到最大量。则v= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化物是一类非常重要的化合物,从人们制得第一种过氧化物距今已有200多年的历史了,在众多的过氧化物中过氧化氢迄今为止仍然得到广泛的应用。
(1)与H2O2具有相同的电子总数的双原子分子有 (写两种);
(2)若从海水中提取碘,需将碘化物变成单质碘。写出在酸性条件下H2O2氧化I—离子的离子方程式 ;
(3)Na2O2、K2O2、CaO2和BaO2都能与酸作用生成H2O2,目前实验室制取H2O2可通过上述某种过氧化物与适量的稀H2SO4作用并过滤后获得,其中最适合的过氧化物是 (填化学式);
(4)纯H2O2可用作火箭燃料的氧化剂,已知0.4mol液态肼(N2H4)与足量的液态H2O2反应,生成N2(g)和H2O(g),放出256.6kJ的热量,则该反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列大小比较正确的是
| A.离子半径:Na+>Mg2+>Al3+>Cl—;原子半径:Na>Mg>Al>Cl |
| B.稳定性:HF>H2O>NH3>CH4; 还原性: HF < H2O < NH3< CH4 |
| C.碱性:CsOH>KOH>Mg(OH)2>NaOH ; 金属性:Cs>K>Mg>Na |
| D.酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com