
| ||
| ||
 ,
, ;HNO3;Cu;
;HNO3;Cu;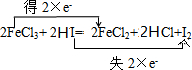 ,
,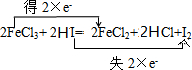 ;FeCl3;HI;
;FeCl3;HI; ,化合价升高元素是Cl,所在反应物HCl是还原剂,对应产物Cl2是氧化产物,化合价降低的是Mn元素,反应物MnO2是氧化剂,对应的MnCl2为还原产物,
,化合价升高元素是Cl,所在反应物HCl是还原剂,对应产物Cl2是氧化产物,化合价降低的是Mn元素,反应物MnO2是氧化剂,对应的MnCl2为还原产物, ;MnO2;MnCl2.
;MnO2;MnCl2.


科目:高中化学 来源: 题型:
| A、用CCl4萃取碘水中的碘,上层的水从分液漏斗的下端放出 |
| B、配制溶液时,摇匀后发现液面低于刻度,再加水至刻度线 |
| C、把溶液从烧杯中转移到容量瓶时用玻璃棒引流 |
| D、称量时,托盘天平的左盘放砝码,右盘放称量药品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
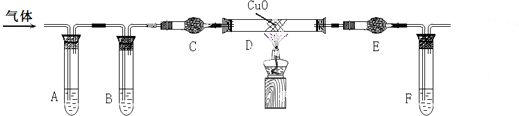
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| M |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com