
【题目】A是一种常见的有机物,其产量可以作为衡量一个国家石油化工发展水平的标志,F是高分子化合物,有机物A可以实现如下转换关系。请回答下列问题:
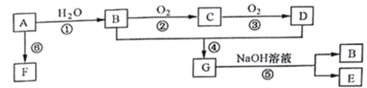
(1)写出A的电子式____________,B、D分子中的官能团名称分别是 _______、_______。
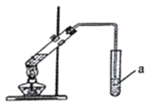
(2)在实验室中,可用如图所示装置制取少量G,试管a中盛放的试剂是____________,其作用为____________;
(3)写出下列反应的化学方程式,并注明反应类型:
①_______________________________ ;
②________________________________;
④________________________________。
【答案】![]() 羟基 羧基 饱和碳酸钠溶液 溶解乙醇,反应乙酸,降低乙酸乙酯的溶解度 CH2 = CH2 + H2O
羟基 羧基 饱和碳酸钠溶液 溶解乙醇,反应乙酸,降低乙酸乙酯的溶解度 CH2 = CH2 + H2O![]() CH3CH2OH,加成反应 2CH3CH2OH+O2
CH3CH2OH,加成反应 2CH3CH2OH+O2![]() 2CH3CHO + 2H2O,氧化反应 CH3COOH+CH3CH2OH
2CH3CHO + 2H2O,氧化反应 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,酯化反应或取代反应
CH3COOCH2CH3+H2O,酯化反应或取代反应
【解析】
A的产量通常用来衡量一个国家石油化工水平,则A是CH2=CH2,乙烯和水发生加成反应生成B,B为CH3CH2OH,乙醇发生催化氧化反应生成C,C为CH3CHO,C进一步氧化生成D,D为CH3COOH,乙酸与乙醇发生酯化反应生成G,G为CH3COOCH2CH3,乙酸乙酯在碱性条件下水解生成乙醇与E,E为CH3COONa;F是高分子化合物,乙烯发生加聚反应生成高分子化合物F,F为![]() ,据此分析解答。
,据此分析解答。
根据上述分析,A是CH2=CH2,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,E为CH3COONa,F为![]() 。
。
(1)A是CH2=CH2,乙烯的电子式为![]() ;B为CH3CH2OH,D为CH3COOH,含有的官能团分别是羟基和羧基,故答案为:
;B为CH3CH2OH,D为CH3COOH,含有的官能团分别是羟基和羧基,故答案为:![]() ;羟基;羧基;
;羟基;羧基;
(2)在实验室中,可用图2所示装置制取少量乙酸乙酯,试管a中盛放的试剂是饱和碳酸钠溶液,其作用为:溶解乙醇,反应乙酸,降低乙酸乙酯的溶解度,故答案为:饱和碳酸钠溶液;溶解乙醇,反应乙酸,降低乙酸乙酯的溶解度;
(3)反应①为乙烯的水化反应,反应的化学方程式为CH2 = CH2 + H2O![]() CH3CH2OH,该反应为加成反应;反应②为乙醇的催化氧化,反应的化学方程式为2CH3CH2OH+O2
CH3CH2OH,该反应为加成反应;反应②为乙醇的催化氧化,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO + 2H2O,属于氧化反应;反应④的化学方程式为:CH3COOH+CH3CH2OH
2CH3CHO + 2H2O,属于氧化反应;反应④的化学方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,属于酯化反应或取代反应,故答案为:CH2 = CH2 + H2O
CH3COOCH2CH3+H2O,属于酯化反应或取代反应,故答案为:CH2 = CH2 + H2O![]() CH3CH2OH,加成反应;2CH3CH2OH+O2
CH3CH2OH,加成反应;2CH3CH2OH+O2![]() 2CH3CHO + 2H2O,氧化反应;CH3COOH+CH3CH2OH
2CH3CHO + 2H2O,氧化反应;CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,酯化反应或取代反应。
CH3COOCH2CH3+H2O,酯化反应或取代反应。


科目:高中化学 来源: 题型:
【题目】(1)有下列六组物质:属于同系物的是_________,属于同分异构体是_________,属于同种物质的是___________。(填序号)

(2)下列实验设计或操作合理的是_______________。
a.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯;
b.只用水就能鉴别苯、硝基苯、乙醇;
c.实验室通过浓硫酸与乙醇反应制取乙烯时,必须将温度计的水银球插入反应液中,测定反应液的温度;
d.将电石与饱和食盐水反应后,直接通入酸性KMnO4溶液检验是否得到乙炔。
(3)按要求书写:
①乙炔的电子式______;②  的系统命名为___________________。
的系统命名为___________________。
③相对分子质量为72且沸点最低的烷烃的结构简式___________________;
④某单烯烃的相对分子质量为84,若该分子内所有碳原子均在同一平面内,则其结构简式为_______________。
⑤C4H10O的同分异构体中,属于醇类且含有“手性碳原子”的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
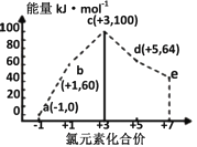
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是探究铁发生腐蚀的装置图,下列说法正确的是

A. 若B处液面上升,A溶液可能是酸性溶液
B. 若A为NaCl溶液,B、C液面始终保持不变
C. 可能产生Fe2O3·nH2O
D. 腐蚀的总反应式一定是:2Fe + O2 + 2H2O === 2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质:①O2和O3;②![]()
![]()
![]() ;③H2O、D2O、T2O;④C16H34和(CH3)2CHCH2CH3;⑤CH3(CH2)3CH3和
;③H2O、D2O、T2O;④C16H34和(CH3)2CHCH2CH3;⑤CH3(CH2)3CH3和![]() ;⑥2-甲基丁烷、异戊烷。
;⑥2-甲基丁烷、异戊烷。
其中互为同位素的是_______;互为同素异形体的是_______;互为同系物的是_______;互为同分异构体的是_______;属于同种物质的是_______。(用序号填空,下同)
(2)为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

①该反应为______反应(填“放热”或“吸热”)。
②A和B的总能量比C和D的总能量___(填“高”或“低”)。
③物质中的化学能通过______转化成______释放出来。
④反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
⑤写出一个符合题中条件的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能用离子方程式:H++OH-=H2O表示的是
A. 2NaOH+H2SO4=Na2SO4+2H2O
B. Ba(OH)2+2HCl=BaCl2+2H2O
C. KOH+HCl=KCl+H2O
D. Cu(OH)2+2HNO3= Cu(NO3)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是
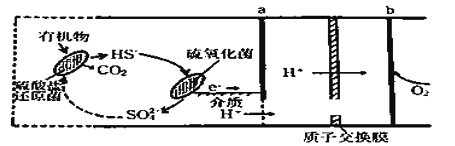
A. HS-在硫氧化菌作用下转化为SO42-的反应为:HS-+4H2O-8e-== SO42-+9H+
B. 电子从b流出,经外电路流向a
C. 如果将反应物直接燃烧,能量的利用率不会变化
D. 若该电池电路中有0.4mol电子发生转移,则有0.45molH+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸甲酯又叫冬青油,是一种重要的有机合成原料。某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入6.9 g (0.05 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时;
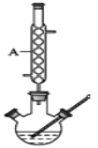
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3 溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯4.5g。
常用物理常数:
名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是___________,制备水杨酸甲酯时,最合适的加热方法是__________。
(2)实验中加入甲苯对合成水杨酸甲酯的作用是_____________________。
(3)反应结束后,分离甲醇的操作是_____________。
(4)洗涤操作中,第一次水洗的主要目的是__________,第二次水洗的主要目的是________。
(5)检验产品中是否含有水杨酸的化学方法是________________________。
(6)本实验的产率为___________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积为1 L的恒容密闭容器中充入2molPCl3和2molCl2,发生反应:PCl3(g)+Cl2(g)![]() PCl5(g)。达到平衡时,PCl5的物质的量为1mol,若此时移走1mol PCl5,则在相同温度下再达到平衡时,PCl5的物质的量约为
PCl5(g)。达到平衡时,PCl5的物质的量为1mol,若此时移走1mol PCl5,则在相同温度下再达到平衡时,PCl5的物质的量约为
A. 0.38mol B. 0.50mol C. 0.63mol D. 0.71mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com