
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
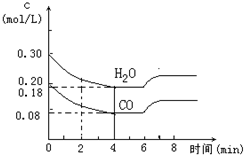
| 0.12mol/L |
| 4min |
| 0.12×0.12 |
| 0.08×0.18 |
| c2 |
| (a-c)×(b-c) |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| A、25℃1 L pH=13的Na2CO3溶液中,Na+数目为0.2NA |
| B、2g D2O中,含中子总数为NA |
| C、将H2O2溶液与酸性KMnO4溶液作用,若有1 molO2生成,转移电子数为4NA |
| D、标准状况下,22.4L甲苯中含有C-H键数目为8 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池总反应的离子方程式为:Mg+H2O2+2H+=Mg2++2H2O |
| B、正极的电极反应为:H2O2+2H++2e-=2H2O |
| C、工作时,正极周围海水的pH减少 |
| D、电池工作时,溶液中的H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L乙醇中含有的氧原子数为NA |
| B、标准状况下,22.4L37Cl2中所含中子数为4NA |
| C、将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ |
| D、25℃时,pH=13的1.0LBa(OH)2溶液中含有OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④⑤ | B、①④ | C、②③ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强酸溶液产生的H2多 |
| B、弱酸溶液产生的H2多 |
| C、两者产生的H2一样多 |
| D、无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,1L 0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
| B、常温常压下,22.4L CH4含有4NA个C-H共价键 |
| C、2mol N2与2mol H2混合充分反应,转移的电子数目为4NA |
| D、10L pH=1的硫酸溶液中含有的H+离子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com