
| A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| C、漂白粉溶液中通入过量CO2气体:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
| D、向NH4Al(SO4)2溶液中不断滴加Ba(OH)2至溶液中SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A、电解精炼铜时阳极溶解与阴极析出的铜的质量 |
| B、6.29 Na2O 和7.89 Na2O2中所含的离子数 |
| C、11.2L N2与14g CO气体所含有的原子数 |
| D、20g重水(D2O)与34g NH3所含有的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0L 1mol?L-1氨水中,NH3?H2O的分子数为6.02×1023 |
| B、当有7.1g Cl2和水完全反应时转移的电子数为0.1×6.02×1023 |
| C、白磷分子(P4)呈正四面体结构,31g白磷中含有P-P键个数为6×6.02×1023 |
| D、20g重水(2H216O)中含有的中子数为8×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 140 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X、Y元素的金属性X<Y |
| B、一定条件下,Z单质与W的常见单质直接生成ZW |
| C、Y的氢氧化物能溶于稀氨水 |
| D、一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3mol?L-1氨水的浓度不够大,溶液的碱性不够强 |
| B、NaF溶液碱性较强,Al3+完全反应生成AlO2-,而AlO2-不能与氨水反应生成Al(OH)3 |
| C、氨水为弱碱溶液,Al3+不与弱碱反应 |
| D、Al3+与F-结合生成新物质,溶液中几乎没有Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.查看答案和解析>>
科目:高中化学 来源: 题型:
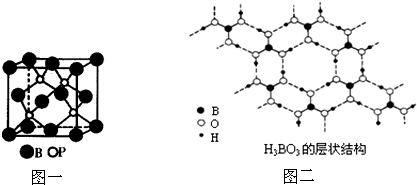
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com