
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ������ݡ��ݴ�����˵������������ ��
���ữѧ��(CP)
(500mL)
Ʒ��������
��ѧʽ��H2SO4
��Է���������98
�ܶȣ�1.84g/cm3
����������98%
A. �������Լ������ʵ���Ũ��Ϊ18.4mol��L-1
B. ��������������ˮ���������Һ��������������49%
C. ����200mL 4.6mol��L-1��ϡ������ȡ������62.5mL
D. ������,��2.7gAlͶ�������������пɵõ���״���µ�����3.36L

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ʹ���ٹ�·�رա�����ͣ�ɣ����ܲ��������ЧӦ�������ڷ�ɢϵ�еģ�������
A.����
B.����Һ
C.��Һ
D.������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ζ����ǻ�ѧ�ϳ��õĶ��������ķ������ζ��ķ���������к͵ζ���������ԭ�ζ��������ζ�����ϵζ��ȣ�
��1����ѧ��ȤС��ȡ20.00mL����ϡ���������ƿ�У����μ�2��3�η�̪��Һ��ָʾ������0.2000molL��1�ı�NaOH��Һ���еζ����ظ������ζ�����3�Σ�����¼���ݣ�
a.�ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲� �� ������ţ�
A���ζ�����Һ��ı仯 B����ƿ����Һ��ɫ�ı仯
b.�жϵζ��յ�������ǣ� ��
c.�����������ݣ���������������Һ��Ũ��Ϊ mol/L��
�ζ����� | ����Һ�����mL�� | ��NaOH��Һ������¼��mL�� | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 20.00 | 0.40 | 20.40 |
�ڶ��� | 20.00 | 4.00 | 24.00 |
������ | 20.00 | 2.00 | 24.10 |
��2���һ�ѧ��ȤС������������ԭ��Ӧ�ζ����ⶨ��ij������ˮ������̬�ȵĺ�����ʵ�����£�
��ȡˮ��10.0ml����ƿ�У�����10.0ml��KI��Һ��������������ָʾ��2��3�Σ�
�ڽ��Լ����Ƶ�0.01molL��1��Na2S2O3��Һװ��ζ����У�����Һ�棬���¶�����
�۽���ƿ���ڵζ����½��еζ��������ķ�ӦΪ��I2+2Na2S2O3=2NaI+2Na2S4O6 �� �Իش������ʴ�
a.����ٷ����Ļ�ѧ��Ӧ����ʽΪ���������ָʾ���� ��
b.�����Ӧʹ��ʽ�ζ��ܣ�
c.�ȵ�����Ũ�ȱ�ʵ��Ũ�Ȼ�ƫ���������ԭ�������������ţ�
A ���Ʊ�Na2S2O3��Һ����ʱ����ˮ�����̶���
B ��ƿˮϴ��ֱ��װ����ˮ��
C װ��Na2S2O3��Һ�ĵζ���ˮϴ��û����ϴ
D �ζ������յ�ʱ�����Ӷ����ζ��ܶ�����
E �ζ�ǰ���첿�������ݣ��ζ�����ʧ
��3�������ζ����õ�ָʾ����������һ�ֳ���������֪һЩ���ε���ɫ��Ksp��20�棩���±����ⶨˮ�����Ȼ���ĺ��������ñ���������Һ���еζ���
��ѧʽ | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ | ��ɫ |
Ksp | 2.0��10��10 | 5.4��10��13 | 8.3��10��17 | 2.0��10��48 | 2.0��10��12 |
a.�ζ�ʱ������Ϊ�õζ�����ѡ�õ�ָʾ���������е� �� ������ţ�
A��KBrB��KIC��K2S D��K2CrO4
b.��BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱ�� ![]() = ��
= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ���������������ԭ������ش��������⣺
��1�������£�Ũ�Ⱦ�Ϊ0.1molL��1������������Һ��pH���±���
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
����������Һ�е������ӣ��������������ǿ����
�ڸ��ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01molL��1�������������ʵ���Һ�У�������ǿ�����������ţ���ͬ��������Һ�ֱ�ϡ��100����pH�仯��С����
A��HCN B��HClO C��C6H5OH D��CH3COOH E��H2CO3
�۾��ϱ����ݣ������ж����з�Ӧ���ܳ������������ţ���
A��CH3COOH+Na2CO3�TNaHCO3+CH3COONa
B��CH3COOH+NaCN�TCH3COONa+HCN
C��CO2+H2O+2NaClO�TNa2CO3+2HClO
D��CO2+H2O+2C6H5ONa�TNa2CO3+2C6H5OH
��Ҫ������ˮ��HClO��Ũ�ȣ�������ˮ�м���������̼������Һ����Ӧ�����ӷ���ʽΪ
��2��CaCO3��һ���������ʣ���KSp=2.8��10��9 �� �ֽ�Ũ��Ϊ2��10��4 mol/L Na2CO3��Һ��CaCl2��Һ�������ϣ�������CaCO3��������CaCl2��Һ����СŨ��Ϊ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڢ�A��Ԫ�ؾ������ƵĻ�ѧ���ʣ����������ǵ�ԭ�Ӿ�����ͬ�ģ�������
A.ԭ�Ӱ뾶
B.���Ӳ���
C.�������
D.����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)Ϊ������������(NOx)����Ⱦ���ɲ��ü������ԭ��:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H3=-867kJ/mol
���H2=_________��
(2)�״���������Ƶ���Ҫ�Ļ�����Ʒ������ȩ���Ʊ�������������ת����ϵ��ͼ��ʾ��
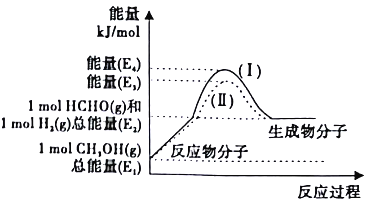
��д��������Ӧ���Ȼ�ѧ����ʽ______________��
�ڷ�Ӧ�ȴ�С�Ƚ�:����I______����II������ڡ�����С�ڡ����ڡ�����
��������Ӧ������,������ϵ��ͨ��������������������������ϵ�е�H2�������ȩ���ʣ�ͬʱʹ��Ӧ�¶ȱ��ֲ��䣬��������n(CH3OH)��n(����)=________������֪:H2(g)+![]() O2(g)==H2O(g) ��H=-akJ/mol��������O2���������Ϊ0.2)
O2(g)==H2O(g) ��H=-akJ/mol��������O2���������Ϊ0.2)
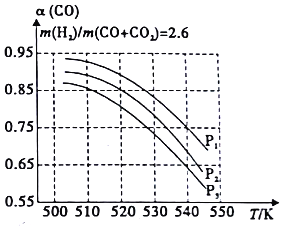
(3)��ҵ�ϳ���CO��CO2��H2�ϳɼ״�ȼ�ϣ���ԭ��Ϊ:
��CO(g)+2H2(g)![]() CH3OH(g) ��H<0
CH3OH(g) ��H<0
��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H>0
CO(g)+H2O(g) ��H>0
������������ɹ̶�ʱ��COƽ��ת����(��)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��ͼ�е�ѹǿ�ɴ�С˳��Ϊ_____���ж�������_____________���Խ���COƽ��ת�������¶��������С��ԭ����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥSO2��������HCl���壬Ӧ���������ͨ��(����)
A.��ˮB.NaHSO3������Һ
C.NaOH��ҺD.NaHCO3������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��EΪ�������ʣ�B�ǵ���ɫ��ĩ�ҳ����ڷ�������У��ش����⡣
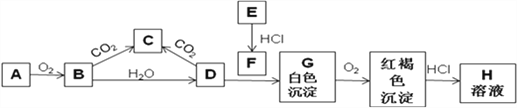
��1��ʵ������A����������ʢ��__________�Ĺ��ƿ�С�
��2��д��Bת���C�Ļ�ѧ����ʽ_______________________��0.1molB����÷�Ӧ��ת�Ƶ��ӵĸ���Ϊ_________ ��
��3���û�ѧ����ʽ��ʾ����G��ɫ�����仯��ԭ��____________________________________________��
��4����A��B��C��D��E��G��Hѡ���Լ����Ʊ�F��д����Ӧ���ӷ���ʽ��______________________________________��
��5��ֱ����F��Һ�м���B���壬д�����ܳ��ֵ�����______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������NaOH���������ˮȷ����һ�����ʵ���Ũ�ȵ�NaOH��Һ�����������У�����Ҫ�õ����ǣ�������
A.�ձ�
B.������
C.����ƿ
D.������ƿ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com