
某化学兴趣小组用以下装置探究SO2的某些化学性质。
(1)装置乙的作用是 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有 (填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式: Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。
(1)尾气处理(2分)
(2)c(2分) a(2分)
(3)Ca2++2ClO-+2SO2+2H2O=CaSO4↓+2Cl-+ SO42-+4H+(2分)
解析试题分析:(1)1体积水中能溶解40体积的二氧化硫,所以用水可吸收二氧化硫,进行尾气处理。
(2)能使品红溶液褪色,说明SO2具有漂白性;若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,SO2与S2?反应生成了S,体现了SO2的氧化性。
(3)ClO?中Cl元素化合价降低,则SO2中S元素化合价升高,生成的沉淀为CaSO4,同时生成H+,配平可得离子方程式:Ca2++2ClO-+2SO2+2H2O=CaSO4↓+2Cl-+ SO42-+4H+
考点:本题考查实验装置的用途、实验现象的分析、离子方程式的配平与书写。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:填空题
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。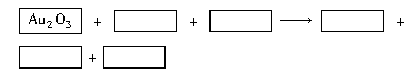
(2)反应中,被还原的元素是 ,还原剂是 。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。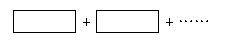
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水处理技术在生产、生活中应用广泛。
(1)工业上常用绿矾作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾。请解释这一做法的原因:_______________________________________________________________________。
(用必要的离子方程式和文字做答)
(2)根据水中Ca2+、Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。①硬水软化的方法通常有________、________和离子交换法。离子交换树脂使用一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于________中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,________洗涤效果较好,原因是________________________________________________________________________。
(3)我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是________________________________________。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理。首先在硝化细菌作用下将NH4+氧化为NO3-:________NH4++________O2=________NO3-+________H++______H2O,然后,加入甲醇与NO3-生成N2:______NO3-+______CH3OH=________N2↑+________CO2↑+________H2O+________OH-。
试配平以上两个离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理: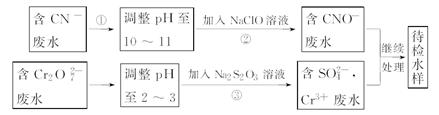
回答下列问题:
(1)上述处理废水流程中主要采用的方法是_____________。
(2)流程②中,反应后无气体放出,该反应的离子方程式为_______。
(3)含Cr3+废水需进一步处理,请你设计一个处理方案:_______。
(4)反应③中,每消耗0.4 mol Cr2O72-转移2.4 mol e-,该反应离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
中国气象局的数据显示,2013年全国平均雾霾天数为52年来之最。形成雾霾的主要成份为:生产生活中排放的废气、汽车尾气及扬尘等。
(1)用CH4可以消除汽车尾气中氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955 kJ/mol
2NO2(g)=N2O4(g) △H=-56.9 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
(2)已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41kJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0molH2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为 ,由此可知在该温度下反应CO2(g)+H2(g)
CO2(g)+H2(g) △H=-41kJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0molH2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为 ,由此可知在该温度下反应CO2(g)+H2(g) CO(g)+H2O(g)的化学平衡常数为 。相同条件下,向同一密闭容器中充入1.0molCO2和1.0molH2反应达到平衡后,吸收的热量为 kJ。
CO(g)+H2O(g)的化学平衡常数为 。相同条件下,向同一密闭容器中充入1.0molCO2和1.0molH2反应达到平衡后,吸收的热量为 kJ。
(3)碱式硫酸铝法烟气脱硫工艺主要有以下三步
①向Al2(SO4)3溶液中投入粉末状石灰石,生成碱式硫酸铝[Al2(SO4)3·Al2O3]溶液。
②碱式硫酸铝吸收SO2,Al2(SO4)3·Al2O3+3SO2=Al2(SO4)3·Al2(SO3)3,请写出Al2(SO4)3·Al2O3与过量烧碱溶液反应的化学方程式 。
③将Al2(SO4)3·Al2 (SO3)3氧化成Al2(SO4)3,可选用氧化剂为 (填代号)
| A.浓硫酸 | B.KMnO4溶液 | C.5%的H2O2溶液 | D.空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
绿矾(FeSO4?7H2O)是中学阶段常用的一种还原剂。
(1)久置的绿矾溶液容易被空气氧化变质,简述检验绿矾溶液已经变质的操作和现象:取少量待测液于试管中, 。
(2)绿矾溶液浓度的标定测定溶液中Fe2+物质的量浓度的方法是:
a.量取25.00mL待测溶液于锥形瓶中;
b.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点;
c.重复操作2次,消耗KMnO4溶液体积的体积分别为20.02mL、24.98mL、19.98mL。
(已知滴定时发生反应的离子方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①判断此滴定实验达到终点的方法是 。
②计算上述滤液中Fe2+物质的量浓度 (保留四位有效数字)。
(3)探究保存绿矾溶液的有效措施
【反应原理】Fe2+在空气中易氧化变质,完成并配平下列离子方程式:
Fe2+ + O2 + = Fe(OH)3↓+ Fe3+
【操作与现象】取4支试管,如图进行实验,请在相应位置上写出试管①的现象和④的添加试剂。
【分析与结论】设计试管①的作用是 ;为了有效保存FeSO4溶液,你认为最佳方案为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某体系中存在如下反应:
①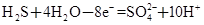 ②
②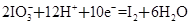
(1)反应①中H2S作_______剂,反应②属于_______反应。(填“氧化”或“还原”)
(2)若在反应①中失去0.2 mol电子,则反应②中可生成_______g碘。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:______。
(4)由上述反应可推知_______。
a.氧化性:K2SO4>KIO3 b.酸性:HIO3>H2SO4
c.还原性:H2S>I2 d.反应过程中溶液的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
(1)氢化钠(NaH)中氢元素的化合价为 。
(2)NaH能与水剧烈反应:NaH+H2O= NaOH+H2↑,该反应中的氧化剂是 。如果有12gNaH与水反应,则转移电子的个数为 。
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)如图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体成,则生成该气体的电极反应式为 。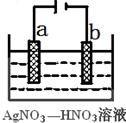
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com