
【题目】某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水,当K闭合时,Y极上产生黄绿色气体。下列分析正确的是( )

A. 溶液中c(SO42+)减小
B. B极的电极反应:B-2e-=B2+
C. Y电极上有Cl2产生,发生还原反应
D. 反应初期,X电极周围出现白色沉淀
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1
O2(g)=CO(g) H2=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
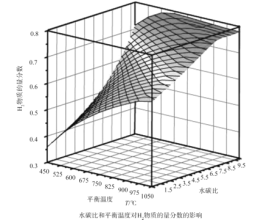
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
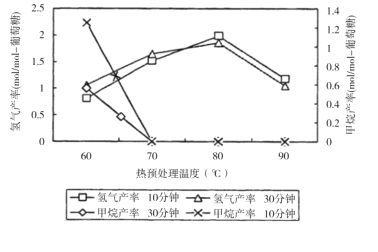
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
a. 以上物质中能导电的是________________________________。
b. 以上物质中属于电解质的是_______________________,属于非电解质的是_______________________。
c. 以上物质中,溶于水且能导电的物质是_______________________。
(2)胶体和溶液的本质区别是________________,鉴别胶体和溶液所采用的方法是观察是否能发生___________效应。
(3)下列3个反应,按要求填写相关量。
①2Na2O2+2H2O=4NaOH+ O2↑反应中,每消耗1 mol Na2O2生成_____ g O2。
②在NaHCO3的热分解反应中,每消耗168 g NaHCO3,标准状况下生成_____L CO2。
③Cl2+H2O=HCl+HClO反应中,标准状况下每消耗22.4LCl2,转移_____mol电子。
(4)在一个密闭容器中放入以下四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下:
物质 | M | N | Q | P |
反应前质量(g) | 50 | 1 | 3 | 12 |
反应后质量(g) | x | 26 | 3 | 30 |
①该变化的基本反应类型是_____反应;
②物质Q在反应中起的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、V、W五种短周期元素,原子序数依次增大,其中Z的原子半径最大,Z的单质在W的单质中燃烧产生黄色火焰;五种元素可以组成一种有机盐(如图所示)。下列说法正确的是( )
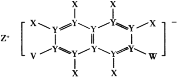
A.Y与W形成的分子中各原子最外层均满足8电子稳定结构
B.原子半径的大小关系为:V >Z > W
C.热稳定性:X与V组成的二元化合物>X与W组成的二元化合物
D.Y与V组成的二元化合物分子中含有两个Y-V键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学设计了如图所示的装置,完成下列问题:
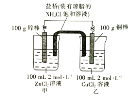
(1)反应过程中,______棒质量增加。
(2)总反应的离子方程式为_____。
(3)反应中,当其中一个电极质量变为102g时,另一电极质量______________(填大于、小于或等于)98g。
(4)反应过程中,盐桥中的________ 离子进入甲杯。
(5)当外电路中转移0.2mol电子时,乙烧杯中浓度最大的阳离子是_________,其物质的量浓度为_______________。(假设溶液体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为________,R的相对原子质量为________。含R的质量为1.6 g的Na2R,其物质的量为________。
(2)86.4gA单质与4.80molCl2完全反应,生成3.20molAClx,则x=___________,A的摩尔质量为__________________g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3AsO3是一种剧毒物,可加入祛毒剂SnCl2来除去,反应方程式为:2H3AsO3+3SnCl2+12X=2As↓+3H2SnCl6+6H2O。下列关于该反应的说法中正确的是( )
A.还原剂是H3AsO3
B.X的化学式为HCl,是该反应的氧化剂
C.每生成0.2molAs,还原剂得到0.6mol电子
D.该反应转移2mol电子,则消耗祛毒剂SnCl2为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是( )
A. 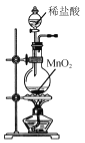 制取Cl2
制取Cl2
B. 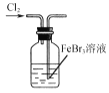 使Br-转化为Br2
使Br-转化为Br2
C. 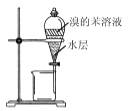 分液,先放出水层,再倒出溴的苯溶液
分液,先放出水层,再倒出溴的苯溶液
D.  将分液后的水层蒸干获得无水FeCl3
将分液后的水层蒸干获得无水FeCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com