
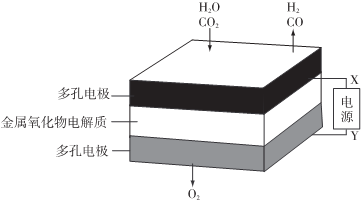
| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:2 |
分析 与X相连的电极产生CO,说明二氧化碳被还原,则X为电源的负极,Y为正极,由图示可知反应的总方程式为H2O+CO2═H2+CO+O2,以此解答该题.
解答 解:A.根据图示知:与X相连的电极产生CO,电解H2O-CO2混合气体,二氧化碳得到电子生成一氧化碳,发生还原反应,电解池阴极发生还原反应,所以X是电源的负极,故A正确;
B.电解池阴极发生还原反应,电解H2O-CO2混合气体制备H2和CO,阴极:水中的氢原子得到电子生成氢气,H2O+2e-═H2↑+O2-,二氧化碳得到电子生成一氧化碳,CO2+2e-═CO+O2-,故B正确;
C.电解H2O-CO2混合气体制备H2和CO,根据图示知:阴极产生H2、CO,阳极产生氧气,所以总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,故C正确;
D.电解H2O-CO2混合气体制备H2和CO,总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,阴极产生H2、CO,阳极产生氧气,阴、阳两极生成的气体的物质的量之比是2:1,故D错误;
故选D.
点评 本题考查电解知识,为高频考点,侧重于考查学生的综合运用能力,题目难度中等,注意基础知识的积累掌握,掌握电解池阳极发生氧化反应,阴极发生还原反应为解答关键.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | S与Cu反应:Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | 酸雨放置过程中pH变小:2H2SO3+O2═2H2SO4 | |
| C. | 亚硫酸氢钙溶液与澄清的石灰水混合:Ca2++HSO3-+OH-═CaSO3↓+H2O | |
| D. | 向Na2S和Na2SO3的混合溶液中滴加稀H2SO4[n(Na2S):n(Na2SO3)=2:1]:2S2-+SO32-+6H+═3S↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去N2中的O2:通过灼热的CuO粉末,收集气体 | |
| B. | 某吸热反应能自发进行,则该反应一定是熵增的反应 | |
| C. |  如图是从化学试剂商店买回的硫酸试剂标签,配制80mL2.3mol•L-1的稀硫酸需量取该硫酸12.5 mL | |
| D. | 下列各种物质在一定条件下反应,所得产物与反应物的用量或与反应条件无关①Na2SiO3+CO2+H2O ②Fe+Cl2 ③Ca(HCO3)2+Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 用该硫酸配制稀硫酸时必须用到托盘天平 | |
| C. | 配制200mL 4.6mol/L的稀硫酸需量取该硫酸50mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | |
| C. | 在0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{c({H}^{+})}{c(OH)}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
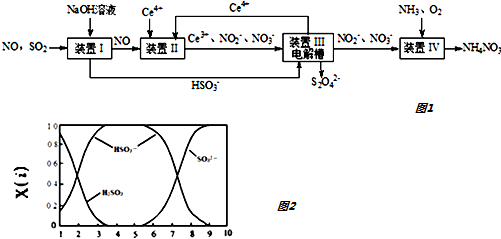
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同质量、不同密度的O2和O3 气体 | B. | 同温度、同体积的O2和O3气体 | ||
| C. | 同压强、同体积的N2O和CO2气体 | D. | 同体积、同密度的N2O和CO2气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com