
【题目】下列说法中正确的是( )
A. 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦
B. 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭
C. 皮肤上溅有较多的浓硫酸,赶紧用水冲洗。
D. 衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中
科目:高中化学 来源: 题型:
【题目】用下图装置完成下列实验,不需要试管①(内盛有相应的除杂试剂)就能达到实验目的的是

实验目的 | ②中的试剂 | |
A | 检验碳与浓硫酸反应产生的气体中含有二氧化碳 | 澄清石灰水 |
B | 用碳酸钙与盐酸反应产生的气体验证碳酸的酸性强于苯酚 | 苯酚钠溶液 |
C | 验证乙醇在浓硫酸作用下发生消去反应产生的气体为不饱和烃 | 酸性高锰酸钾溶液 |
D | 验证石蜡油在碎瓷片上受热分解产生的气体中含有不饱和烃 | 溴的四氯化碳溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式______________________。
⑵NH2-的电子式为_______________。
⑶N3-有________个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式_____、____。
⑸等电子数的微粒往往具有相似的结构,试预测N3—的构型___________________。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在工农业生产中有着重要作用,请回答下列各有关问题。
(1)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) ![]() CO(NH2)2(l)+H2O(g) △H<0.某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。下图中的曲线表示该反应在前25 s内NH3浓度随时间的变化而变化。
CO(NH2)2(l)+H2O(g) △H<0.某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。下图中的曲线表示该反应在前25 s内NH3浓度随时间的变化而变化。

①0~25s、25s~40s内NH3的化学反应速率分别为__________、__________。存在差异的原因是______________________。
②该温度下此反应的平衡常数为_______________。
③请在图中画出反应从25s延续至60s时c(NH3)随时间变化的图像。并在其他条件不变的情况下画出使用催化剂时c(NH3)随时间的变化图像_______________
(2)尿素在一定条件下能将燃煤产生的烟气中的氮氧化物NOx转化为N2,下图表示的是尿素与某种烟气(主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线

①曲线a对应CO(NH2)2与NO的物质的量的比值是______。
②CO(NH2)2与NO反应的化学方程式为________________。
③曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______mg/(m3s)。
(3)希腊科学家采用高质子导电性的SYC陶瓷(能传递H+)为介质,用吸附在它外表面的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。钯电极A是电解池的____(填“阳”或“阴”)极,该电极上的电极反应式是_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醇燃料电池(KOH电解质)为电源,在实验室中模拟铝制品表面“钝化”处理的过程。实验中,通电一段时间后可观察到铝电极逐渐失去光泽,并出现细小气泡,装置如图所示,下列说法正确的是

A. 燃料电池b电极上发生的反应为:CH4O-6e-+H2O=6H++CO2↑
B. 电解池中石墨电极做阴极,发生反应为:2H++2e-=H2↑
C. 电解池中Al电极上的反应为:Al-3e-+3HCO3-=AI(OH)3↓+3CO2↑
D. 理论上毎生成19.5 g沉淀,标准状况下a电极上消耗掉O2 2.1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
(1)乙酸是合成乙酸乙酯的重要原料,制备原理如下:
CH3COOH(l)+ C2H5OH(l)![]() CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol
CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol
已知:CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78 ℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示:
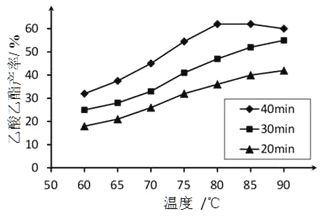
①该研究小组的实验目的是________________。60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
②如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________;
③利用此原理制得的乙酸乙酯粗品中常含有一定量的乙酸、乙醇以及微量的硫酸,提纯时可向粗品中加入__________溶液进行充分洗涤,分离出有机层,并加入无水硫酸钠干燥,最后经过__________、_______两步操作即可得到纯品。
(2)乙二酸俗名草酸(二元弱酸,结构简式:HOOC—COOH),被广泛的应用于抗生素类药物的合成。
①实验室中经常利用酸性KMnO4溶液滴定法测其纯度。已知草酸与酸性KMnO4溶液反应过程有无色无味气体产生,且KMnO4溶液紫色褪去,写出草酸与酸性KMnO4溶液反应的离子方程式_____________________;
②资料表明:25℃时草酸的电离平衡常数Ka1=6.0×10-2;Ka2=6.4×10-5;据此分析,室温时草酸氢钾(KHC2O4)的水解反应平衡常数Kh=________(单位省略,计算结果保留两位有效数字),其溶液中c(H2C2O4)________c(C2O42-)(填“小于”、“等于”或“大于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是H2(g)+Cl2(g)=2HCl(g)反应过程中的能量变化图。

(1)由图可知,1 mol H2(g)和1 mol Cl2(g)的总能量____(填“>”、“<”或者“=”) 2 mol HCl(g)的能量。
(2)该反应是___________(填“吸”或者 “放”)热反应,从化学键的角度进行解释__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,可逆反应N2+3H2 ![]() 2NH3已达到平衡,下列有关说法中正确的有( )
2NH3已达到平衡,下列有关说法中正确的有( )
①1个N≡N键断裂的同时,有3个H—H键形成 ②反应混合物中各组分的体积分数保持不变 ③N2 H2的转化率一定相等 ④1个N≡N键断裂的同时,有6个N—H 键形成 ⑤气体的平均相对分子质量不再改变 ⑥N2 H2 NH3的物质的量之比一定为1∶3∶2,
A. ①②⑤ B. ①②④⑤ C. ③⑤⑥ D. ②④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com