
��13�֣���Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI�� CO(g) �� 2H2(g)  CH3OH(g)
��H1
CH3OH(g)
��H1
��ӦII�� CO2(g) �� 3H2(g)  CH3OH(g)
+ H2O(g) ��H2
CH3OH(g)
+ H2O(g) ��H2
�� ������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� ���I������
�� �±����������Ƿ�ӦI�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
|
�¶� |
250�� |
300�� |
350�� |
|
K |
2.041 |
0.270 |
0.012 |
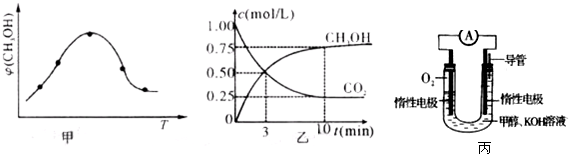
�ɱ��������жϦ�H1 0 �����������������������
�� ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CH3OH)�� 0.8 mol��L����CO��ת����Ϊ ����ʱ���¶�Ϊ �����ϱ���ѡ��
�ܺ��¡�����ʱ�������������˵����ӦI�Ѿ��ﵽ��ѧƽ��״̬����________________��
 a�����������ʵ�Ũ�ȱ��ֲ��䣻 b��������ѹǿ���ֲ��䣻
a�����������ʵ�Ũ�ȱ��ֲ��䣻 b��������ѹǿ���ֲ��䣻
c����(CO)����==1/2��(H2)���� �� d �������ڵ��ܶȱ��ֲ���
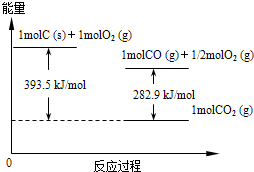
��2��25�桢101kPaʱ��ȼ��16gҺ��״�����CO2��H2O(l)���ų�������Ϊ363.26kJ��д���״�ȼ�յ��Ȼ�ѧ����ʽ�� ��
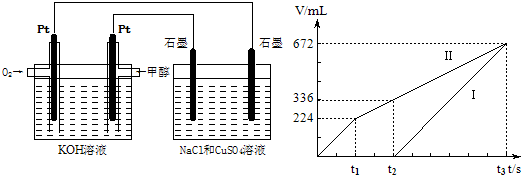
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�������һ��ȼ�ϵ�ص��Na2SO4��Һ(ͼ����)�������ͼʾ�ش��������⣺
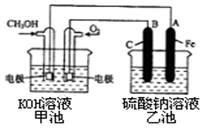
�� ͨ��״������ĵ缫ӦΪ ������д�������������� �õ缫�Ϸ����ĵ缫��Ӧ�� ������ĸ���ţ���
a.2CH3OH ��12 e- +3O2 === 2CO2 + 4 H2O
b.CH3 OH��6 e- + 8 OH- === CO32- + 6H2O
c.O2 + 2H2O + 4 e- === 4OH- ����������
d.O2�� 4 e- + 4H+ === 2H2O
��д���缫A������ ��д��B�缫�ĵ缫��Ӧʽ ��
�۵����Լ״�ȼ�ϵ������3.36 L ����ʱ���ۺ�Ϊ��״�����������ϵ��Na2SO4��Һ��������������ʵ����� ��
��1���٢� �ڣ� ��80%��250�� ��d
��2��CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ��H=-726.52kJ/mol
��3���� �� b �� ������4OH-+4e=O2��+2H2O ��0.45mol
����������1���ٸ��ݷ���ʽ��֪����Ӧ���з�Ӧ��ȫ������״��У���Ӧ���ϡ�ԭ�Ӿ��á�ԭ��
���ɱ������ݣ������¶ȵ����ߣ�ƽ�ⳣ����С��˵�������¶�ƽ�����淴Ӧ�����ƶ�����������Ӧ�Ƿ��ȷ�Ӧ��
�۴ﵽƽ����c(CH3OH)�� 0.8 mol��L��������CO��0.8mol/L��������ת������0.80mol/L��2L��2mol��100����80����ƽ��ʱCO��������Ũ�ȷֱ���0.2mol/L��1.4mol/L������ƽ�ⳣ��K��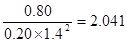 �������¶���250�档
�������¶���250�档
����һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬������a��˵������Ӧǰ�������С������ѹǿҲ�Ǽ�С�ģ����bҲ��˵����C�з�Ӧ���ʵķ����෴������������֮������Ӧ�Ļ�ѧ������֮�ȣ���˵�����ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ�d����˵����ѡd��
��2��16gҺ��״���16g��32g/mol��0.5mol�������Ȼ�ѧ����ʽΪ
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ��H=-726.52kJ/mol��
��3����ԭ����и���ʧȥ���ӣ����Լ״��ڸ���ͨ�룬���ڵ�������������أ����Ե缫��ӦʽΪCH3 OH��6 e- + 8 OH- �� CO32- + 6H2O����ѡb��
��A���Դ�ĸ�����������������B����������Һ�е�OH��ʧȥ���ӣ�����ʽΪ
4OH-+4e=O2��+2H2O��
��3.36L������3.36L��22.4L/mol��0.15mol��ת�Ƶ�����0.15mol��4��0.6mol�����Կ�����������0.3mol������0.15mol��������0.45mol��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����| 4 |
| 27 |
| 4 |
| 27 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?������һģ����Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��2012?������һģ����Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com