
| A. | 硫原子的原子结构示意图: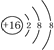 | |
| B. | 过氧化钠的电子式: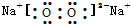 | |
| C. | 原子核内有8个质子、10个中子的氧原子:810O | |
| D. | HClO的结构式为 H-Cl-O |
分析 A.根据硫原子没有发生电子的转移核电荷数和电子数不变分析;
B.过氧化钠属于离子化合物,根据离子化合物的电子式表示方法判断;
C.原子核内有8个质子、10个中子的氧原子的质量数为18;
D.次氯酸的中心原子为氧原子,其分子中不存在氢氯键.
解答 解:A.硫原子的核电荷数为16,核外电子数为16,正确的原子结构示意图为: ,故A错误;
,故A错误;
B.过氧化钠为离子化合物,电子式中需要标出阴阳离子所带的电荷数,过氧化钠的电子式为: ,故B正确;
,故B正确;
C.原子核内有8个质子、10个中子的氧原子的质量数是18,不是10,正确表示方法为:818O,故C错误;
D.次氯酸分子中不存在氢氯键,HClO正确的结构式为:H-O-Cl,故D错误;
故选B.
点评 本题考查了化学用语的分析判断,题目难度中等,涉及了原子结构示意图、电子式、元素符号、结构式等知识,熟练掌握化学用语表示方法是解题关键,试题培养了学生规范答题的能力.


科目:高中化学 来源: 题型:选择题
| A. | F是最活泼非金属,Li是最活泼金属 | |
| B. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| D. | NaOH易溶于水,Ca(OH)2微溶,所以NaOH碱性比Ca(OH)2强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2L | B. | 33.6L | C. | 22.4L | D. | 6.72L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式表明了分子中各原子的个数和连接方式 | |
| B. | 结构式、结构简式可表示分子中各原子的连接方式和相对位置 | |
| C. | 球棍模型可表示分子的真实形态 | |
| D. | 比例模型较真实反映分子空间构型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
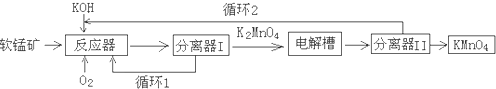
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
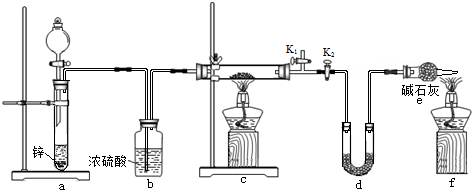
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

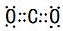 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
| B | 将SO2通入Ba(NO3)2溶液 | 产生白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| C | 向硫酸铝溶液中滴加过量的氢氧化钡溶液 | 产生白色沉淀 | 氢氧化铝不溶于过量的氢氧化钡溶液 |
| D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀H2SO4 | B. | CuSO4溶液 | C. | AgNO3溶液 | D. | Fe2(SO4)3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com