
【题目】CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJmol—1
CO(g)+3H2(g) △H1=+206.1kJmol—1
②2H2(g)+CO(g)![]() CH3OH(l) △H2=-128.3kJmol—1
CH3OH(l) △H2=-128.3kJmol—1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJmol—1
写出由甲烷和氧气合成液态甲醇的热化学方程式:_____________________。
(2)若利用反应①来制备氢气。为了探究温度、压强对反应①的影响,设计以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ mol·L—1 | H2O初始浓度/ mol·L—1 |
1 | 400 | 101 | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | P | 3.0 | 7.0 |
Ⅰ、实验1、实验2和实验3比较,反应开始时正反应速率最快的是_________;平衡时CH4的转化率最小的是_________。
Ⅱ、实验2和实验3相比,其平衡常数关系:K2______K3(填“>”、“<”或“=”)。
(3)科学家提出由CO2制取碳(C)的太阳能工艺如图1所示.

①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为______;
②“热分解系统”中每分解l mol FexOy,同时生成标准状况下气体体积为_______。
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。如某溶液中溶质的浓度为1×10—2molL—1,则该溶液中溶质的pC=﹣lg(1×10—2)=2。上图2为25℃时H2CO3溶液的pC﹣pH图。请回答下列问题:
①
②在8<pH<10时,溶液中HCO3—的pC值不随着pH增大而减小的原因是____;
③求H2CO3一级电离平衡常数的数值Ka1= _______________。
【答案】 2CH4(g)+O2 (g)![]() 2CH3OH(l) △H=-328.0kJmol—1 实验2或2 实验3或3 > Fe3O4 11.2L H+、HCO3— 随着pH增大、HCO3—电离使pC(HCO3—)增大,H2CO3电离使pC(HCO3—)减小 10-6
2CH3OH(l) △H=-328.0kJmol—1 实验2或2 实验3或3 > Fe3O4 11.2L H+、HCO3— 随着pH增大、HCO3—电离使pC(HCO3—)增大,H2CO3电离使pC(HCO3—)减小 10-6
【解析】(1)甲烷和氧气合成液态甲醇的热化学方程式(①+②)![]() 2+②得:2CH4(g)+O2 (g)
2+②得:2CH4(g)+O2 (g)![]() 2CH3OH(l) △H=-328.0kJmol—1。
2CH3OH(l) △H=-328.0kJmol—1。
(2)由图数据知Ⅰ、实验1、是标准。实验2和实验3是通过和实验1,探究温度、压强对反应①的影响有数据可知实验2是改变温度,实验3是改变压强,温度和压强都比实验1大,所以反应开始时正反应速率最快的是实验2和实验3;因为①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJmol—1是吸热反应,升高温度平衡向正反应方向进行,CH4的转化率增大,又是一个气体体积增大的反应,增大压强,平衡逆向移动,CH4的转化率减小。所以实验3平衡时CH4的转化率最小。
CO(g)+3H2(g) △H1=+206.1kJmol—1是吸热反应,升高温度平衡向正反应方向进行,CH4的转化率增大,又是一个气体体积增大的反应,增大压强,平衡逆向移动,CH4的转化率减小。所以实验3平衡时CH4的转化率最小。
Ⅱ、结合上述分析,实验2和实验3相比,其平衡常数关系:K2>K3
(3) ①由图分析:CO2![]() C 转移电子4mol且n(FeO)∶n(CO2)=6∶1 FexOy
C 转移电子4mol且n(FeO)∶n(CO2)=6∶1 FexOy![]() FeO。由此确定FexOy化学式为Fe3O4
FeO。由此确定FexOy化学式为Fe3O4
因为FexOy为Fe3O4,分解时发生反应为 2 Fe3O4=6FeO + O2![]() ,分解l mol,同时生成标准状况下气体体积为11.2L。
,分解l mol,同时生成标准状况下气体体积为11.2L。
(4)①根据图像在0<pH<4时,H2CO3溶液中主要存在的离子是H+、HCO3—,
②根据图像在8<pH<10时,溶液中HCO3—的pC值不随着pH增大而减小的原因是随着pH增大、HCO3—电离使pC(HCO3—)增大,H2CO3电离使pC(HCO3—)减小。
③根据题意pC=﹣lg(1×10—2)=2知C(H2CO3)= 1×10—2 molL—1由图知C(HCO3—)= 1×10—3 molL—1 C(H+)= 1×10—5 molL—1H2CO3一级电离平衡常数的数值Ka1=(C(HCO3—).C(H+))/C(H2CO3)= 10-6答案:10-6


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2。“气化炉”中主要反应有:C(s)+ +H2O (g) =CO(g)+H2(g) △H= +131.3 kJmol-1
CO(g)+H2O(g) =CO2(g)+H2(g) △H= — 41.2kJmol-1
(1)气化炉中CO2与C反应转化为CO,该反应的热化学方程式是 __________________________________。
(2)用煤炭气合成甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如右图所示:
CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如右图所示:
①生成甲醇的反应为_______(填“放热”或“吸热”)。
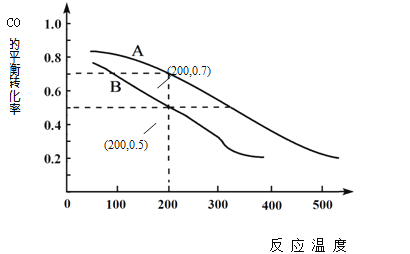
②图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强是5.0MPa的曲线是____________(填“A”或“B”)。
③在不改变反应物用量的前提下,为提高CO转化率可采取的措施有 _______________________ 。
④压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是 _______________。
(3)某新型电池以熔融碳酸盐作电解质,在650℃下工作,负极通入煤炭气,正极通入空气与CO2的混合气.电池的正极反应式为O2+2CO2+4e-=2CO32—,负极反应式为 ___________________和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2、及(NH4)4[UO2(CO3)3]等,回答下列问题:
(1)基态氟原子的价电子排布图为________________;用Mg或Ca还原UF4可得金属铀,其氧化产物MgF2的熔点高于CaF2,原因是_______________________________;
(2)已知:2UO2+5NH4HF2![]() 2UF4·2NH4F+3NH3↑+4H2O↑
2UF4·2NH4F+3NH3↑+4H2O↑
①NH4HF2中存在的微粒间的作用力是__________(填选项字母)。
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的第一电离能由大到小的顺序是__________(填元素符号)。
(3)已知:3(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
①分解产物中属于非极性分子的是_________(填选项字母)。
A.NH3 B.CO2 C.N2 D.H2O
②反应物中的CO32-的空间构型为_____________。分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则CO32-中的大
),则CO32-中的大![]() 键应表示为______________。
键应表示为______________。
③HN3(氢叠氮酸)常用于引爆剂,其分子的结构式可表示为:![]() 。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
(4)UO2的晶胞结构如图所示:
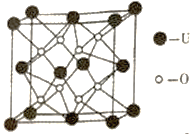
①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的___________空隙中。(填“立方体”、“四面体”、“八面体”)
②若两个氧原子间的最短距离为a nm,则UO2晶体的密度为___________g·cm-3(列出计算式即可,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.Na2O2、Fe3O4、CuO均为碱性氧化物
B.盐酸、水玻璃、氨水均为混合物
C.烧碱、冰醋酸、四氯化碳均为电解质
D.稀豆浆、硅酸、氯化铁溶液均为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.工业上可用铝热反应大规模炼铁
B.SO2常用于纸张等植物纤维的漂白
C.Si是重要的半导体材料
D.电解熔融MgCl2 , 可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应自发性的说法正确的是
A. △H<0、△S>0的反应,有利于自发进行
B. 化合反应都是放热反应,分解反应都是吸热反应
C. 凡是放热反应都是自发的,吸热反应都是非自发的
D. 自发反应在任何条件下都能自动进行,现象明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下水溶液中H+ 和OH- 的浓度变化曲线如图,下列说法正确的是
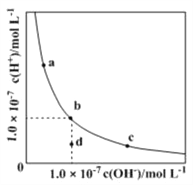
A. 升高温度,可能引起c向b的变化
B. 该温度下,水的离子积常数为![]()
C. 该温度下,加入HCl可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Q适用于治疗高血压、心绞痛,可由有机物P和L制备。

(1)有机物P的合成路线如下。

已知:![]() (R、R’、R”代表烃基或氢)
(R、R’、R”代表烃基或氢)
① A的分子式为C3H8O,其所含的官能团是_______。
② B的核磁共振氢谱只有一个吸收峰,其结构简式是_______。
③ 由D生成有机物P的反应类型是_______。
(2)有机物L的合成路线如下。

已知:![]()
① 生成E的化学方程式是_______。
② ![]() 与有机物M发生加成反应, M的结构简式为_______。
与有机物M发生加成反应, M的结构简式为_______。
③ F含羧基,化合物N是_______。
④ 生成有机物L的化学方程式是_______。
(3)以![]() 为起始原料合成聚合物甲的路线如下:
为起始原料合成聚合物甲的路线如下:

写出聚合物甲的结构简式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com