
下列离子方程式中,正确的是
A.碳酸氢钠溶液与稀盐酸混合:HCO3-+H+===H2O+CO2↑
B.稀硫酸滴在铁片上: 2Fe+6H+===2Fe3++3H2↑
C.硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+SO42-
D.硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+NO3-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年山西省校高一上学期期中化学试卷(解析版) 题型:选择题
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是
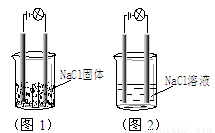
A.NaCl是非电解质
B.将图2中的NaCl溶液换成液态HCl,灯泡也亮
C.将图2中的NaCl溶液换成SO2的水溶液,灯泡也亮,说明SO2是电解质
D.电解质本身不一定能导电
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高二上学期期中化学试卷(解析版) 题型:选择题
关于用水制取二级能源氢气,以下研究方向不正确的是
A.水由氢氧两种元素构成,可研究在水分解的情况下,使氢能成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找特殊化学物质,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源以分解水制取氢气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高二上学期期中化学试卷(解析版) 题型:选择题
下列属于氧化还原反应又是吸热反应的是
A.二氧化碳与赤热的炭反应生成一氧化碳
B.葡萄糖在人体内氧化分解
C.锌粒与稀H2SO4反应制取H2
D.Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高一上学期期中考试化学试卷(解析版) 题型:计算题
(18分)有关物质的量的计算【第(4)问每空2分,其余每空1分】:
(1)2 mol CO(NH2)2中含________mol C,________ mol N,________ mol H,所含氧原子跟________g H2O所含氧原子个数相等。
(2)标准状况下有a、9.03×1023个NH3分子。b、44.8L CH4 c、85g H2S气体下列对这三种气体的关系从大到小的顺序是:① 物质的量 ;② 质量 ;③ 原子总数 ;④密度 。(用a、b、c填空)
(3)含有相同氧原子数的CO和CO2,其质量之比为 ,同温同压下的体积之比为 。
(4)12.4 g Na2X含有0.4 mol Na+,Na2X的摩尔质量为__________,其相对分子质量为________,X的相对原子质量为__________,该物质的化学式为_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高一上学期期中考试化学试卷(解析版) 题型:选择题
“纳米材料”是粒子直径为1~100 nm的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省校高二上学期期中化学试卷(解析版) 题型:填空题
(19分)(1)已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ,则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) kJ的热量。
(2)已知在常温常压下:
①CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H1=-442.8 kJ/mol
②2CO(g)+O2(g)=2CO2(g);ΔH2 =-566.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式__________________________________________
(3)已知合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);ΔH= -92.2 kJ·mol-1
2NH3(g);ΔH= -92.2 kJ·mol-1
下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1
③此条件下该反应的化学平衡常数K= (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省校高二上学期期中化学试卷(解析版) 题型:选择题
对于反应2C4H10(g) + 13O2(g) == 8CO2(g) + 10H2O(l);△H= -5800kJ/mol,下列叙述错误的是
A.该反应的反应热为△H= -5800kJ/mol,是放热反应;
B.该反应的△H与各物质的状态有关,与化学计量数也有关;
C.该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ;
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com