
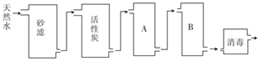
分析 (1)砂滤的作用是除去海水中悬浮杂质,活性炭具有吸附性,臭氧具有强氧化性,还原产物无毒,A、B的作用除去钙、镁离子,应先透过金属阳离子,否则生成氢氧化钙损坏离子交换膜;
(2)书写氧化还原方程式时,根据题意先确定反应产物:应将CN-氧化成无毒的CO2和N2两种气体,而ClO2被还原为Cl-;再利用化合价升降法配平化学方程式:Cl元素由+4-→-1价,C元素由+2-→+4,N元素由-3-→0价;
(3)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
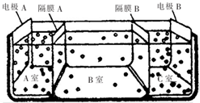
(4)①电极A接直流电源的正极,电极B接直流电源的负极,A室发生氧化反应,是氢氧根离子放电,C室发生还原反应,是氢离子放电,B室盛放海水,为保持电中性,阴离子向A室移动,阳离子向B室移动;
②海水不能直接通入C室中,是因为海水中的镁离子、钙离子在电解过程中会形成氢氧化物沉淀堵塞阳离子交换膜;
③A室有酸生成,溶液呈酸性,B室为水,为中性,C室有碱生成,溶液呈碱性;
(5)生成ng固体为BaCO3,物质的量为:$\frac{ng}{197g/mol}$,故碳酸钠的质量为:$\frac{ng}{197g/mol}$×106g/mol=$\frac{106n}{197}$g,故氯化钠的质量为(m-$\frac{106n}{197}$),
得到氯化钠质量分数.
解答 解:(1)砂滤的作用是除去水中悬浮杂质,A、B的作用除去钙、镁离子,应先透过金属阳离子,则A为阳离子交换膜,B为阴离子交换膜,不能放反A、B,否则水中的Ca2+、Mg2+会与阴离子树脂中的OH-生成Mg(OH)2、Ca(OH)2沉淀造成堵塞,损坏离子交换树脂,
故答案为:过滤除去水中悬浮物;阳离子交换树脂,阴离子交换树脂;
(2)将CN-氧化成无毒的CO2和N2两种气体,而ClO2被还原为Cl-该离子反应为2ClO2+2CN-═2CO2↑+N2↑+2Cl-,故答案为:2ClO2+2CN-═2CO2↑+N2↑+2Cl-;
(3)某天然水中c(Ca2+)=8×10-4mol•L-1,c(Mg2+)=5×10-4mol•L-1,
c(Ca2+)=1.2×10-3mol•L-1,c(Mg2+)=6×10-4mol•L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=8×10-4mol,相当于CaO质量=8×10-4mol×56g/mol=44.8mg,1L水中镁离子物质的量=5×10-4mol,相当于氧化镁质量5×10-4mol×40g/mol=20mg,所以水的硬度=$\frac{44.8mg}{10mg}$+$\frac{20mg}{7.1mg}$=7.3°,
故答案为:7.3°;
(4)①电极A接直流电源的正极,电极B接直流电源的负极,A室发生氧化反应,是氢氧根离子放电,C室发生还原反应,是氢离子放电,B室盛放海水,为保持电中性,阴离子向A室移动,阳离子向B室移动,阳离子交换膜只允许阳离子自由通过,阴离子交换膜只允许阴离子自由通过,则隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,淡水从B室流出,
故答案为:B室;
②海水不能直接通入C室中,理由是海水中含有较多的镁离子、钙离子,电解过程中会生成氢氧化镁、氢氧化钙沉淀,从而堵塞阳离子交换膜,
故答案为:海水中含有较多的镁离子、钙离子,电解过程中会生成氢氧化镁、氢氧化钙沉淀,从而堵塞阳离子交换膜;
③A室有酸生成,溶液呈酸性,B室为水,为中性,C室有碱生成,溶液呈碱性,故溶液pH值:pHa<pHb<pHc,其中pH最小的是pHa,
故答案为:pHa;
(5)生成ng固体为BaCO3,物质的量为:$\frac{ng}{197g/mol}$,故碳酸钠的质量为:$\frac{ng}{197g/mol}$×106g/mol=$\frac{106n}{197}$g,
故氯化钠的质量为(m-$\frac{106n}{197}$),
则氯化钠质量分数为=$\frac{m-\frac{106n}{197}}{m}$×100%=(1-$\frac{106n}{197m}$)×100%,
故答案为:(1-$\frac{106n}{197m}$)×100%.
点评 本题以信息形式考查污水处理、自来水净化、海水淡化等,明确发生的反应原理及净化流程为解答的关键,注重化学与生活的联系,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是含有食品添加剂的食物对人体健康有害,不宜食用 | |
| B. | 乙醇和汽油都属于可再生能源,应大力推广使用乙醇汽油 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | PM2.5是指大气中直径≤2.5微米的颗粒物,其颗粒直径小,面积大,活性强,易附带有毒、有害物质(如重金属、微生物等),对人体健康和大气环境质量的影响很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
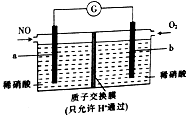 用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )
用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )| A. | a极是该电极的正极 | |
| B. | 电流由a极经导线流向b极 | |
| C. | a极的电极反应式为NO-3e-+2H2O═NO3-+4H+ | |
| D. | 若消耗2.24L(标准状况下)氧气,则会有0.4 molH+通过质子交换膜进入a极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
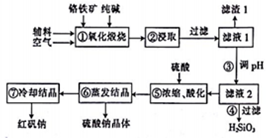 红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,在印染、电镀等行业应用十分广泛.工业上以铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)为原料制取红矾钠的流程如图所示.
红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,在印染、电镀等行业应用十分广泛.工业上以铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)为原料制取红矾钠的流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
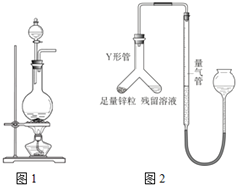 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
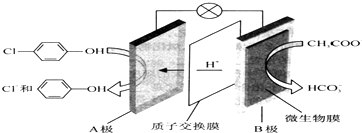
| A. | B为电池的正极,发生还原反应 | |
| B. | A极的电极反应式为: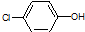 +e-=Cl-+ +e-=Cl-+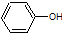 | |
| C. | 电流方向为从B极沿导线经小灯泡流向A极 | |
| D. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+个数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )加氢产物1,2二甲基环己烷(
)加氢产物1,2二甲基环己烷( )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )| A. | 5种 | B. | 6种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 126C、136C、146C三种核素互为同素异形体 | |
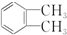
| B. | 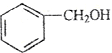 和 和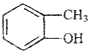 的分子式相同,化学性质也相同 的分子式相同,化学性质也相同 | |
| C. | 等质量的甲烷按a,b两种途径完全转化,途径a比途径b消耗更多的O2 途径a:CH$→_{催化剂}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O;途径b:CH4$→_{燃烧}^{O_{2}}$CO2+H2O | |
| D. | 铝热反应实验说明:在一定条件下铝的还原性强于很多难熔金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com