
【题目】同学们在实验室里用不同的方法分别制取Cu(NO3)2,并在此基础上探究Cu(NO3)2的化学性质。
(1)甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2,反应的化学方程式是___。
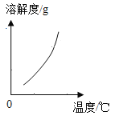
(2)乙组同学查阅了硝酸铜晶体的溶解度曲线(下图),据此设计了以下实验方案,先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、____________、过滤、洗涤、干燥。乙组同学认为此方案优于甲组的方案,理由之一是_____。
(3)丙组同学用Cu(NO3)2晶体,探究其热稳定性,实验装置如下所示。(夹持装置和加热仪器未画出)

①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,红棕色气体是____________。
②集气瓶中最终收集到的气体颜色是____________,U形管中进入集气瓶后颜色发生变化的原因是___。
③欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解],实验方案是___。
④由该实验可得出的结论是___。
【答案】3Cu+8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O 降温结晶 不会产生污染环境的 NO NO2 无色 3NO2 + H2O = 2 HNO3 + NO 取少量黑色粉末于试管中,向其中滴加足量稀硫酸,黑色粉末全部溶解,得到蓝色溶液 Cu(NO3)2 晶体的热稳定性较差
【解析】
(1)铜与稀硝酸反应生成硝酸铜、NO和水,据此书写;
(2)根据硝酸铜的溶解度与温度的关系分析判断;
(3)①根据气体的颜色判断气体的成分;
②二氧化氮溶于水生成硝酸和NO;
③根据氧化铜能溶于酸溶液中,溶液显蓝色分析判断;
④根据实验现象分析判断。
(1)甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2,同时还有NO和水生成,反应的化学方程式是3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(2)根据图像可知硝酸铜的溶解度受温度影响较大,因此欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、降温结晶、过滤、洗涤、干燥。先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,因此不会产生污染环境的NO,所以此方案优于甲组的方案。
(3)①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,因此红棕色气体是NO2。
②由于二氧化氮溶于水生成硝酸和一氧化氮,所以集气瓶中最终收集到的气体颜色是无色,二氧化氮进入集气瓶后颜色发生变化的原因是由于二氧化氮与水反应,方程式为3NO2+H2O=2HNO3+NO。
③氧化铜是碱性氧化物,能与酸反应,则欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解]的实验方案是取少量黑色粉末于试管中,向其中滴加足量稀硫酸,黑色粉末全部溶解,得到蓝色溶液。
④根据以上分析可知,由该实验可得出的结论是Cu(NO3)2晶体的热稳定性较差。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色的气体,易溶于水,是目前国际上公认的第四代高效、无毒的消毒剂。
(1)目前,氯化钠电解法是一种可靠的工业生产ClO2的方法(如图所示)。

用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极反应式___________________。
(2)将ClO2用水吸收得到溶液,为了测定该溶液的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.0mL试样,取其中10.00mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤20,加入足量的KI晶体,充分反应;
步骤3:加入淀粉溶液作指示剂,用0.2mol·L-1Na2S2O3标准溶液滴定至终点,再重复2次,测得消耗Na2S2O3溶液的平均值为20.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①若步骤2所得溶液放置时间太长,则测定结果会__________。(填“偏高”、“偏低”或“不变”)
②步骤3中,滴定终点的现象是__________________ 。
③通过计算确定原ClO2溶液的物质的量浓度。(写出计算过程)_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性溶液中分解产生S、SO2。
Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得,实验室模拟该工业过程的装置如图所示。
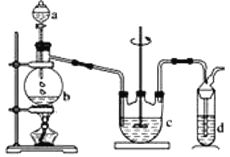
(1)b中反应的离子方程式为____,c中试剂为_____。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_____。
(3)实验中要控制SO2生成速率,可以采取的措施有______(写出两条)。
(4)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是____。
(5)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:_____。
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)
Fe(S2O3)33-(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O32-
装置 | 编号 | 试剂X | 实验现象 |
| ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色, 30s后溶液几乎变为无色 |
② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(6)根据实验①的现象,初步判断最终Fe3+被S2O32-还原为Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:_____。
(7)同浓度氧化性:Ag+ > Fe3+。实验②中Ag+未发生氧化还原反应的原因是____。
(8)进一步探究Ag+和S2O32-反应。
装置 | 编号 | 试剂X | 实验现象 |
| ③ | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:Ag2S2O3+___=Ag2S+___
(9)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和___有关(写出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及到 H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法不正确的是 ( )
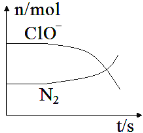
A. 该反应中Cl-为还原产物
B. 氧化剂与还原剂物质的量比为3:2
C. 消耗1 mol还原剂,转移6 mol电子
D. 氧化性:ClO-比 N2强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24LHF所含分子数为0.1NA
B. 某温度下,2LpH=12的NaOH溶液中含OH-的数目为0.02NA
C. 化学反应中每生成1molO2,转移的电子数为4NA
D. 丙烯和环丙烷组成的42g混合气体分子中共用电子对总数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图 a、b、c、d均为铂电极,供选择的电解质溶液如下表。要满足条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等。则应选用的电解液是
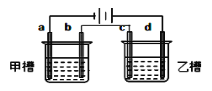
组 | A | B | C | D |
甲槽 | KCl | NaCl | NaOH | Cu(NO3)2 |
乙槽 | AgNO3 | NaNO3 | CuSO4 | NaCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铝箔包着2.3g金属钠,放入50ml水中,放出的H2体积(标准状况)是
A.等于2.24LB.等于1.12LC.大于1.12LD.小于1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com