
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为 101℃,易溶于水,受热易脱水、升华,170℃以上分解。 常温下它的电离常数 K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)查阅资料知:草酸晶体 175℃分解成 CO2、CO、H2O,请写出草酸晶体分解的化学反应方程 式:_____。
(2)请用下列的装置(图中加热装置已略去)分解草酸晶体以制备少量 CO 气体,最佳的连接顺序 为:_____。(填字母序号)
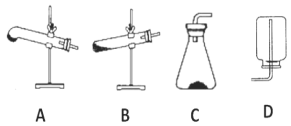
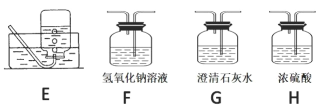
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____(填序号)。
A.室温下,测 0.1mol/L 的 H2C2O4 溶液与 H2SO4 溶液的 pH,硫酸溶液的 pH 比草酸的小;
B.室温下,取 pH=3 的 H2C2O4 溶液稀释 100 倍后,测其 pH<5;
C.标况下,取 0.10mol/L 的 H2C2O4 溶液 100mL 与足量锌粉反应,收集到 H2 体积为 224mL。
(4)现需要配制 900mL1mol/L 的草酸溶液。
①需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、________ 、_________ (填仪 器名称)。
②下列操作会使所配溶液浓度偏低的是_____。(填字母)
A.称量时用了生锈的砝码
B.容量瓶未干燥即用来配制溶液
C.H2C2O4·2H2O 晶体失去了部分结晶水
D.定容时,仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(5)用草酸滴定 KMnO4 溶液的方法可测定 KMnO4 粗品的纯度(质量分数)。
①滴定过程中反应的离子方程式为_____。
②量取 KMnO4 样品溶液应选用_________ (填“酸式”或“碱式”)滴定管;若量取 KMnO4 样品溶液的 滴定管用蒸馏水洗净后未润洗,则最终的测定结果将_______(填“偏大”、“偏小”或“不变”)。
③现取 KMnO4 粗品 10g,配成 100mL 溶液,取 25.0 mL 用(4)中配制的草酸溶液滴定,并进行 3 次 平行实验,所用的草酸溶液的体积分别为 23.00 mL、20.02 mL、19.98 mL,请问 KMnO4 粗品的质量分数 为_____________。(已知:KMnO4 的摩尔质量为 158g/mol)
【答案】H2C2O4+2H2O = CO↑+CO2↑ +3H2O↑A-F-G-EAB玻璃棒1000mL 容量瓶DE2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O酸式偏小50.56%
【解析】
(1)草酸晶体的受热分解生成CO、CO2、水,根据得失电子守恒,CO、CO2的比为1:1,方程式是H2C2O4·2H2O![]() CO↑+CO2↑ +3H2O↑;故答案为:H2C2O4·2H2O
CO↑+CO2↑ +3H2O↑;故答案为:H2C2O4·2H2O![]() CO↑+CO2↑ +3H2O↑;
CO↑+CO2↑ +3H2O↑;
(2)给试管里的晶体加热时,为防止反应生成的水或所含结晶水在管口液化后倒流引起试管破裂,要求试管口要向下倾斜,又因为试管底下垂,可防止草酸晶体熔化后从试管流出,则加热装置选择A;为制备分解产物中的CO,先要排除已证明生成的CO2对实验的干扰,可用F装置吸收CO2气体,并利用G装置证明CO2已经除尽,最后用排水法收集CO,所以最佳的连接顺序为A-F-G-E;故答案为:A-F-G-E;
(3)A.室温下,测0.1mol/L的H2C2O4溶液与H2SO4溶液的pH,硫酸溶液的pH比草酸的小,说明草酸溶液中存在电离平衡,证明草酸是弱酸,故A正确;
B.室温下,取pH=3的H2C2O4溶液稀释100倍后,测其pH<5,说明稀释促进电离,溶液中存在电离平衡,为弱酸,故B正确;
C.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL,强酸和弱酸都符合,和强酸弱酸无关,故C错误;
答案选AB;
(4) ①配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,用托盘天平称取草酸,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀;所以需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、1000mL容量瓶。故答案为:玻璃棒、1000mL 容量瓶;
②A.称量时用了生锈的砝码,草酸物质的量偏大,会使所配溶液浓度偏高; B.容量瓶未干燥即用来配制溶液,无影响; C.H2C2O4·2H2O晶体失去了部分结晶水,草酸物质的量偏大,会使所配溶液浓度偏高; D.定容时,仰视刻度线,溶液体积偏大,会使所配溶液浓度偏低; E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,溶液体积偏大,使所配溶液浓度偏低。故答案为:DE;
(5)①用草酸滴定KMnO4溶液,高锰酸根离子被还原为锰离子、草酸被氧化为二氧化碳,反应离子方程式是2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O;
②KMnO4具有氧化性,能腐蚀橡胶,所以量取KMnO4样品溶液应选用酸式滴定管;若量取KMnO4样品溶液的滴定管用蒸馏水洗净后未润洗,造成高锰酸钾的物质的量偏小,消耗草酸的的体积偏小, 根据c(待测)=![]() ,最终的测定结果将偏小;故答案为:酸式、偏小;
,最终的测定结果将偏小;故答案为:酸式、偏小;
③3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,第一次实验消耗草酸溶液的体积偏离正常误差,根据第二次、第三次实验数据消耗草酸溶液的平均体积是20.00 mL,设高锰酸钾的纯度为x%,
2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O
2 5
![]() 1mol/L
1mol/L![]() 0.02L
0.02L
x%=50.56%,故答案为:50.56%。


科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的。请回答下列问题:

(1)描述D在元素周期表中的位置:_____________________________。
(2)在A、B、C、E四种元素最高价氧化物对应的水化物中酸性最强的是__________(写化学式,下同),非金属最简单气态氢化物最不稳定的是_____________________。
(3)写出满足下列条件分子的结构式_________________________
①所有原子最外层是8个电子; ②C和E组成的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnSO4·7H2O和CuSO4·5H2O的部分实验步骤如下:
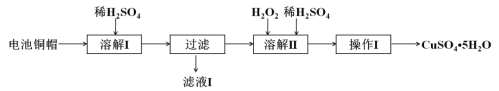
(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是___________、____________。
(2) 从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为__________、__________、过滤、冰水洗涤、低温干燥。
(3)在“溶解II”步骤中,发生反应的离子方程式为____________________________。
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol·L-1Na2S2O3溶液至刚好完全反应,消耗Na2S2O3溶液25.00mL。已知:2Cu2++4I-===2CuI(白色)↓+I2, 2S2O32-+I2===2I-+S4O62- 请依据实验数据计算样品中CuSO4·5H2O的质量分数(写出计算过程)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如图所示:
2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如图所示:


下列说法中正确的是
A. 30~40 min间该反应使用了催化剂
B. 反应方程式中的x=1,正反应为吸热反应
C. 30 min时降低温度,40 min时升高温度
D. 30 min时减小压强,40 min时升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含 卤 族 元 素 的 化 合 物 在 科 研 和 生 产 中 有 许 多 重 要 用 途 。 如 : 2 m o l S b ( C H 3 ) 3 、 2 m o lSb(CH3)2Br 和 2molSb(CH3)Br2 进行重组反应可生成空间位阻最小的离子化合物:[Sb2(CH3)5]2 [Sb2(CH3)2Br6],已知 Sb 与 N 同主族。请回答:
(1) 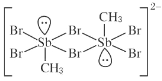 中,H、C、Br 的电负性由小到大的顺序为_____,溴原子的价电子排布式 为_____。
中,H、C、Br 的电负性由小到大的顺序为_____,溴原子的价电子排布式 为_____。
(2)[Sb2(CH3)5] +的结构式为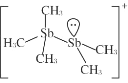 ,Sb 原子的杂化轨道类型为_____。写出一种与CH3 -互为等电子体的分子_____。
,Sb 原子的杂化轨道类型为_____。写出一种与CH3 -互为等电子体的分子_____。
(3)X 射线衍射测定等发现,I3AsF6 中存在 I3+ 离子。I3+ 离子的几何构型为_____。
(4)一定条件下 SbCl3 与 GaCl3 以物质的量之比为 l:l 混合得到一种固态离子化合物,其结构组成可能 为:(a) [GaCl2+ ][SbCl4- ]或(b) [SbCl2+ ][GaCl4- ],该离子化合物最可能的结构组成为_____ (填“a”或“b”),理由是_____。
(5)固态 PCl5 结构中存在 PCl4+ 和 PCl6 -两种离子,其晶胞如图所示。
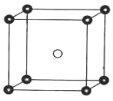
已知晶胞的边长为 a pm ,阿伏加德罗常数值用 NA表示。则 PCl4+ 和 PCl6 - 之间的最短距离为_____pm,固态 PCl5 的密度为_____gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的分类或变化正确的是( )
①混合物:氯水、氨水、水玻璃、水银、食醋、淀粉 ②含有氧元素的化合物叫氧化物 ③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2 为碱性氧化物 ④同素异形体:C60、C70、金刚石、石墨 ⑤在熔融状态下能导电的化合物为离子化合物 ⑥强电解质溶液的导电能力一定强 ⑦有单质参加的反应或有单质产生的反应是氧化还原反应 ⑧煤的气化、液化、干馏都是化学变化
A. ④⑤⑧ B. ②③⑤ C. ①④⑥⑦ D. ③④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2 和 Zn 是制造普通干电池的重要原料,现用软锰矿(主要成分为 MnO2)和闪锌矿(主要成分为 ZnS)制备MnO2和Zn的工艺流程如下:
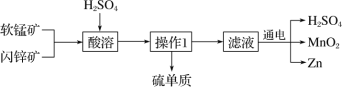
下列说法不正确的是( )
A. 酸溶时,ZnS 作还原剂 B. 原料硫酸可以循环使用
C. 操作 1 是萃取 D. 不可用盐酸代替硫酸进行酸溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列说法正确的是( )
A.H2 和 H3 属于同素异形体B.C60 的摩尔质量为 720 g
C.O2 和 O4 属于同位素D.N5+离子中含有 36 个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的位置如下图所示,若W原子最外层电子数是其内层电子总数的3/5。下列说法中,正确的是

A. X只有一种氧化物
B. 气态氢化物的稳定性Z>W
C. 原子半径由大到小排列顺序Z>Y>X
D. 元素X是自然界中形成化合物种类最多的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com