
分析 (1)①根据方程式,失电子的物质作负极;电解质溶液中含有得电子的Ag+;
②根据正极反应式计算Ag的物质的量,带入m=nM计算质量;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算,化学反应中,反应物的总能量大于生成物的总能量,反应放热,反之吸热,以此计算反应热并判断吸热还是放热;
(3)CH3COONa和HCl反应生成CH3COOH和NaCl,因CH3COONa的物质的量大于HCl,所以醋酸钠有剩余,溶液中的溶质为NaCl、CH3COOH、CH3COONa,且CH3COONa的物质的量与CH3COOH的物质的量之比为3:2,
①溶液中存在电离平衡H2O?H++OH-、CH3COOH?CH3COO-+H+,水解平衡CH3COO-+H2O?CH3COOH+OH-,据此判断溶液中存在的粒子;
②任何电解质溶液中都存在物料守恒,根据物料守恒判断;任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:(1)①原电池中失电子的物质作负极,负极发生氧化反应,根据反应方程式知,Cu作负极,电解质溶液中含有得电子的Ag+,可用硝酸银溶液作电解质溶液,
故答案为:Cu;氧化;硝酸银溶液;
②由Ag++e-=Ag可知,导线上转移电子1mol,则被还原生成1molAg,质量为1mol×108g/mol=108g,
故答案为:108;
(2)拆1molH-H键、1molN≡N、1molN-H键分别需要吸收的能量为436kJ、946kJ、391kJ,在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ,
吸收的能量少,放出的能量多,该反应为放热反应,
放出的热量为:2346kJ-2254kJ=92kJ,
所以生成1mol NH3放出热量为46KJ;
故答案为:放出;46KJ;
(3)CH3COONa和HCl反应生成CH3COOH和NaCl,因CH3COONa的物质的量大于HCl,所以醋酸钠有剩余,溶液中的溶质为NaCl、CH3COOH、CH3COONa,且CH3COONa的物质的量与CH3COOH的物质的量之比为3:2,
①溶液中存在电离平衡 H2O?H++OH-、CH3COOH?CH3COO-+H+,水解平衡CH3COO-+H2O?CH3COOH+OH-,所以溶液中存在的粒子有H2O、H+、OH-、CH3COOH、CH3COO-、Na+、Cl-,所以一共有7种微粒,故答案为:7;
②任何电解质溶液中都存在物料守恒,根据物料守恒得n(CH3COO-)+n(CH3COOH)=0.010mol;溶液中存在电荷守恒,根据电荷守恒得n(CH3COO-)+n(OH-)+n(Cl-)=n(H+)+n(Na+),所以的n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol,
故答案为:CH3COO-;CH3COOH;0.006.
点评 本题考查原电池的设计、反应热的计算、离子浓度大小比较,题目难度不大,(3)中明确溶液中的溶质是解本题关键,再利用电荷守恒、物料守恒解答,会判断溶液中存在的微粒,为易错点.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | 将铁屑、溴水、苯混合制溴苯 | |
| B. | 在苯中滴入浓硝酸制硝基苯 | |
| C. | 用乙醇和乙酸混合共热制取乙酸乙酯 | |
| D. | 将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、K+、Mg2+、Cl- | B. | Ba2+、SO42-、Cl-、OH- | ||
| C. | K+、OH-、CO32-、MnO4- | D. | Ca2+、H+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、S、N所形成的氧化物均为酸性氧化物 | |
| B. | “水滴石穿”是因为CaCO3与CO2、水发生了化学反应 | |
| C. | 常用作水处理剂的KAl(SO4)2和漂白粉都是强电解质 | |
| D. | 232Th 转变成233U是化学变化,233U和235U的化学性质几乎相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
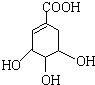
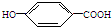 ),其反应类型是消去反应.
),其反应类型是消去反应.
 +CH3CH218OH$?_{△}^{浓硫酸}$
+CH3CH218OH$?_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com