
A、B、C、D、E、F元素是原子序数依次增大的6种短周期元素。已知A是短周期元素中原子半径最小的元素,A和B形成的18电子的化合物X常用作火箭的燃料,C原子最外层电子数与核外电子总数之比为3∶4,E与C同主族,D和C可以形成原子个数比为1∶1和2∶1的两种离子化合物。
据此回答下列问题:
(1)D和C形成1∶1的化合物中阴阳离个数比为____________。
(2)化合物X的结构式为____________。1 mol气态X在适量C2中燃烧,生成B2和气态A2C, 放出534 kJ的热量,1 mol液态A2C完全汽化需吸收44 kJ热量。请写出气态X在C2中燃烧生成B2和液态A2C时的热化学方程式_____________________________________
(3)某化合物由上述6种元素中的3种元素组成,为常见家用消毒剂的主要成分,其中化学键类型为__________________;该化合物水溶液不呈中性的原因是(用离子方程式表示)__________________________________,该化合物可以通过电解D和F形成化合物的水溶液获得,电解时反应的化学方程式为_________________________________
(4)写出一个可以证明C的非金属性大于E的化学反应方程式:_____________________________________________。
(1)1∶2
(2)NHHNHH N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-622 kJ/mol
(3)离子键和共价键 ClO-+H2O??HClO+OH- NaCl+H2O NaClO+H2↑
NaClO+H2↑
(4)O2+2H2S=2H2O+2S
【解析】根据题意可推出A、B、C、D、E、F分别为H、N、O、Na、S、Cl。(1)D元素的氧化物为氧化钠和过氧化钠,两种化合物中阴阳离子个数比均为1∶2。(2)根据题意可知化合物X为N2H4,结构式为NHHNHH,根据题意可写出热化学方程式:① N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ· mol-1 ,② H2O(g)=H2O(l) ΔH=-44 kJ· mol-1。根据盖斯定律①+2×②可得:N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-622 kJ· mol-1。
(3)由上述6种元素中的3种元素组成的常见家用消毒剂的主要成分为NaClO,由于ClO-的水解,NaClO溶液呈碱性。制备的化学方程式为NaCl+H2O NaClO+H2↑。
NaClO+H2↑。
(4)证明氧的非金属性大于硫可用反应O2+2H2S=2H2O+2S


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:选择题
下列各溶液中,微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC )+c(H+)>c(C
)+c(H+)>c(C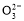 )
)
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S )>c(N
)>c(N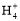 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC )>c(H+)
)>c(H+)
D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:填空题
工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等。
已知:
①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。
③下表为一些金属氢氧化物沉淀的pH参照数据。
物质 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.7 | 4.7 |
Cr(OH)3 | 4.7 | a |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.6 | 11.1 |
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4·7H2O),加入绿矾的目的是_____________________________________________
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是____________________________________________________________;
常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5 mol·L-1视为沉淀完全],溶液的pH应调于a=________。
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含____________________溶质的溶液。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷B(解析版) 题型:选择题
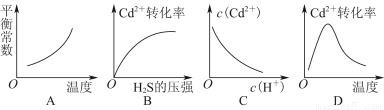
含Cd2+废水可通过如下反应转化为CdS,以消除镉对环境的污染:
Cd2+(aq)+H2S(g) CdS(s)+2H+(aq) ΔH<0
CdS(s)+2H+(aq) ΔH<0
该反应达到平衡后,改变横坐标表示的条件,下列示意图正确的是( )
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
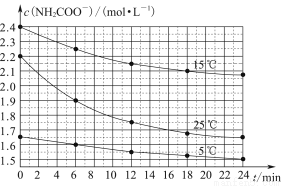
A.0~12 min,初始浓度越大的实验,水解反应速率越大
B.c(NH2COO-)将随反应时间的不断延长而一直减小至0
C.25 ℃时0~6 min,v(NH2COO-)为0. 05 mol·L-1·min-1
D.15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
甲、乙、丙、丁是原子序数依次增大的4种短周期元素,A、B、C、D、E是由其中的2种或3种元素组成的化合物,F是由丙元素形成的单质。已知:A+B=D+F,A+C=E+F; 0.1 mol·L-1D溶液的pH为13(25 ℃)。下列说法正确的是( )
A.原子半径:丁>丙>乙>甲
B.乙元素在周期表中的位置为第三周期第ⅣA族
C.1 mol A与足量B完全反应共转移了1 mol电子
D.1.0 L 0.1 mol·L-1E溶液中阴离子总的物质的量小于0.1 mol
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
下列变化需克服相同类型作用力的是( )
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钠的溶解 D.溴和汞的汽化
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:选择题
下列事实相对应的离子方程式,不正确的是( )
A.将NaHSO3溶于水,溶液呈弱酸性:HSO3—+H2O SO32—+H3O+
SO32—+H3O+
B.工业上用热的纯碱溶液吸收溴蒸气生成溴酸钠:3Br2+3CO32—=5Br-+BrO3—+3CO2
C.明矾溶液中加Ba(OH)2溶液至SO42—完全沉淀:Al3++2SO42—+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓
D.用惰性电极电解MgCl2溶液产生气体和白色沉淀:Mg2++2Cl-+2H2O Cl2↑+H2↑+Mg(OH)2↓
Cl2↑+H2↑+Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷B(解析版) 题型:实验题
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:

(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是 。按照乙同学的观点,该装置需做的改进是
。
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4。
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl溶液,1 mol·L-1 HNO3溶液,1 mol·L-1 BaCl溶液,1 mol·L-1 Ba(NO3)2溶液,0.01 mol·L-1 KMnO4酸性溶液。
实验步骤 | 预期现象和结论 |
步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
步骤2:往Ⅰ试管中加入 ,再滴加 | , |
则证明生成物中含Na2SO4 |
|
步骤3:往Ⅱ试管中 |
|
| 若 , |
则证明生成物中有Na2SO3;若 |
|
|
|
则说明生成物中没有Na2SO3。 |
|
(4)生成物中亚硫酸钠含量的测定:
①取a g生成物配制成100 mL溶液,取10.00 mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0 mol·L-1碘水进行滴定,滴定终点现象为 。记录数据,重复滴定2次,平均消耗碘水20.00 mL。
②计算:生成物中亚硫酸钠的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com