
 锂是制造化学和电源的重要原料,如LiFePO4电池某电极的工作原理如图所示,下列有关说法正确的是( )
锂是制造化学和电源的重要原料,如LiFePO4电池某电极的工作原理如图所示,下列有关说法正确的是( )| A、充电时该电极为阴极 |
| B、放电时该电极的反应式为FePO4+e-+Li+=LiFePO4 |
| C、放电时Li+向负极移动 |
| D、该电池可以用硫酸溶液作电解质 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是其周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578KJ?mol-1 I2=1817KJ?mol-1 I3=2745KJ?mol-1I4=11575KJ?mol-1 I5=14830KJ?mol-1 I6=18376KJ?mol-1 |
| Q为前四周期中电负性最小的元素 |
| 元素R位于周期表的第10列 |
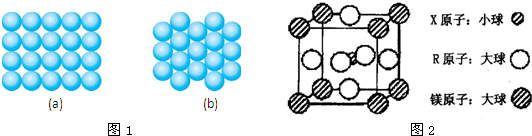
查看答案和解析>>
科目:高中化学 来源: 题型:
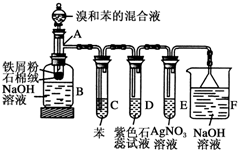 苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉.填写下列空白:
苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉.填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
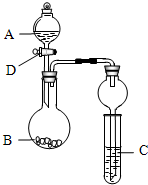 某同学设计了如图装置(夹持仪器省略)进行系列实验时,将药品A逐滴加入到固体B中,请根据下列实验回答问题.
某同学设计了如图装置(夹持仪器省略)进行系列实验时,将药品A逐滴加入到固体B中,请根据下列实验回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取7.8mL浓H2SO4 |
| B、用碱式滴定管量取18.20mLKMnO4溶液 |
| C、酸碱中和滴定时,滴定管和锥形瓶需分别用标准液和待测液润洗 |
| D、读取标准液读数时,若滴定前仰视,滴定后俯视,会导致测定结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )| X | Y | |
| A | HCl | 饱和食盐水 |
| B | CO2 | 稀H2SO4 |
| C | SO2 | NaOH |
| D | H2S | 溴水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有氨水、醋酸、盐酸、氯化铵四种溶液,请回答下列问题:
现有氨水、醋酸、盐酸、氯化铵四种溶液,请回答下列问题:| C(NH3?H2O) |
| C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、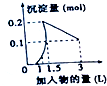 表示向1L浓度均为0.1mol.L-1的Ba(OH)2、NaAlO2混合液中逐滴加入0.1mol.L-1稀H2SO4溶液 |
B、 表示常温下,两份足量、等浓度的盐酸与等量锌粉反应时,其中一份滴加了少量硫酸铜溶液 |
C、 表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
D、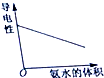 表示向醋酸溶液中滴入氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com