
����Ŀ�������£����ȡ0.1mol/LHA��Һ��0.1mol/LNaOH��Һ��������(���Ի�Ϻ���Һ����ı仯)����û����Һ��pH��8���Իش��������⣺
��1�������Һ��pH��8��ԭ��(�����ӷ���ʽ��ʾ)��____��
��2�������Һ����ˮ�������c(H��)____0.1mol/LNaOH��Һ����ˮ�������c(H��)��(������������������������)
��3��������Һ��������ʽ�ľ�ȷ������(���������)��c(Na��)��c(A��)��____mol/L��c(OH��)��c(HA)��____mol/L��
��4����֪NH4A��ҺΪ���ԣ���֪HA��Һ�ӵ�Na2CO3��Һ��������ų������ƶ�(NH4)2CO3��Һ��pH_____7(��������������С��������������)����ͬ�¶��µ�Ũ�ȵ���������Һ��
A��NH4HCO3 B��NH4A C��(NH4)2SO4 D��NH4Cl
��pH�ɴ�С��˳�������ǣ�_____(�����)��
���𰸡�)A����H2O![]() HA��OH�� �� 9.9��10��7 10��8 ���� ABDC
HA��OH�� �� 9.9��10��7 10��8 ���� ABDC
��������
�����£������ʵ�����HA��NaOHǡ�÷�Ӧ����NaA�������Һ�ʼ��ԣ�˵��NaAΪǿ�������Σ���HAΪ���ᡣ
��1��A-ˮ���NaA��Һ�ʼ��ԣ�ˮ�ⷽ��ʽΪ��A-+H2OHA+OH-��
�ʴ�Ϊ��A-+H2OHA+OH-��
��2�����κ������������ܴٽ�ˮ���룬����������ǿ��������ˮ���룬���Ի����Һ����ˮ�������c��H+����0��1molL-1NaOH��Һ����ˮ�������c��H+����
�ʴ�Ϊ ����
��3���ɵ���غ��֪��c��Na+��-c��A-��=c��OH-��-c��H+��=10-6-10-8=9��9��10-7mol/L�� 0��1mol/L HA��Һ��0��1mol/L NaOH��Һ������������NaA��Һ����û����Һ��pH=8��c��H+��=10-8mol/L����Һ�Լ��ԣ�˵��A-����ˮ�⣬��Һ�д��������غ㣺c��OH-��=c��H+��+c��HA������c��OH-��-c��HA��=c��H+��=10-8mol/L��
�ʴ�Ϊ 9.9��10��7 ��10��8��
��4����HA��Һ�ӵ�Na2CO3��Һ��������ų���˵��HA�����Ա�̼���ǿ��NH4A��ҺΪ���ԣ� ˵����ͬ�����£���ˮ��HA�ĵ���̶���ͬ�����ԣ�NH4��2CO3��笠����ӵ�ˮ��̶�С��̼������ӵ�ˮ��̶ȣ�������Һ��pH��7����NH4��2SO4 ��NH4Cl��ǿ�������Σ�笠�����ˮ�����Һ�����ԣ���Һ��笠�����Ũ��Խ��ˮ��̶�ԽС����ˮ��ĸ����࣬�����Ȼ����Һ��pHֵ��������泥�NH4A��Һ���������ӵ�ˮ��̶���ȣ�������Һ�����ԣ���Һ��pHֵ�����Ȼ�泥�NH4HCO3��Һ��笠����ӵ�ˮ��̶�С��̼��������ӵ�ˮ��̶ȣ���Һ�ʼ��ԣ�������Һ��pH ֵ�����pH��С˳��ΪA��B��D��C��
�ʴ�Ϊ�����ڣ�ABDC��


 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£�


�����ºϳɲ���ش����⣺
(1)��a�м���15 mL��ˮ����������м����b��С�ļ���4.0 mLҺ̬�壬��a�е��뼸���壬�а�������������Ϊ������_____���壬�����μ���Һ����꣬װ��d��������______��
(2)Һ�����������в�������ᴿ��
����a�м���10 mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10 mLˮ��8 mL10����NaOH��Һ��10 mLˮϴ�ӣ�NaOH��Һϴ�ӵ�������_____��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˣ������Ȼ��Ƶ�Ŀ����_____��
(3)������������������屽�л����е���Ҫ����Ϊ_______��Ҫ��һ���ᴿ�����в����б������_______(������ȷѡ��ǰ����ĸ)��
A. �ؽᾧ B. ���� C. ���� D. ��ȡ
(4)�ڸ�ʵ���У�a���ݻ����ʺϵ���_____(������ȷѡ��ǰ����ĸ)��
A. 25 mL B.50 mL C. 250 mL D. 500 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ���(H2NCH2CH2NH2) ��NH3���ƣ�ˮ��Һ�ʼ��ԣ�25��ʱ����10mL0.1mol��L-1�Ҷ�����Һ�еμ�0.1 mol��L-1���ᣬ����ֵ����ʵ�������������ҺpH�ı仯������ͼ��ʾ������˵���������
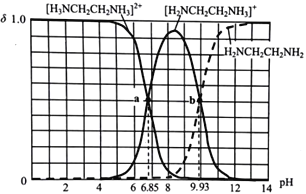
A. �����Һ������ʱ���μ���������С��10mL
B. Kb2[H2NCH2CH2NH2] ��������Ϊ10-8
C. a ����������Һ�У�c(H+)+3c([H3NCH2CH2NH3]2+)=c(OH-) +(Cl-)
D. ˮ�ĵ���̶�:a>b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����Ũ�Ⱦ�Ϊ0.1mol/L������ֱ�Ϊ![]() ��
��![]() ��HA��Һ��BOH��Һ����ͬ����Ȼ�ϣ�����
��HA��Һ��BOH��Һ����ͬ����Ȼ�ϣ�����![]() +
+![]() =100mL��
=100mL��![]() ��
��![]() ������Һ��pH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
������Һ��pH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
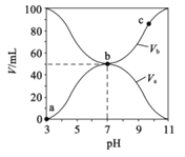
A.a��b������ˮ�ĵ���̶�ʼ������
B.![]() mol/L1
mol/L1
C.b��ʱ��c(B-)=c(A-)=c(OH-)=c(H+)
D.��ͼ��֪BOHһ����ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AgCl�ij����ܽ�ƽ��ΪAgCl(s)![]() Ag+(aq)+Cl(aq)������˵���д�����ǣ� ��
Ag+(aq)+Cl(aq)������˵���д�����ǣ� ��
A.��AgCl����Һ�м�����ˮ��c(Ag+)һ����С
B.AgCl������Һ��c(Ag+)=![]() mol/L
mol/L
C.��NaCl��Һ��������ˮϴ��AgCl���������Լ��ٳ�����ʧ
D.��ӦAgCl+NaBr=AgBr+NaCl���У�˵���ܽ�ȣ�AgCl>AgBr
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС���Ե�·���ʴҺ�����д���Cu2+��Fe2+��Fe3+��Ϊԭ���Ʊ�����Cu20���Ʊ��������£�

��֪����Cu2O�ڳ�ʪ�Ŀ����л�������������CuO��Ҳ�ױ���ԭΪCu; Cu2O������ˮ���������ڼ�����Һ��Cu2O+2H+ =Cu2++Cu+H2O��
������Cu2O�ķ�Ӧ��4Cu(OH)2+N2H4H2O=2Cu2O+N2��+7H2O
��ش�
��1������II��д������CuR2��Ӧ�����ӷ���ʽ��____________________________
��2������II�����ˮ������ȡ���ϲ���ȡҺ��Ŀ����___________________________
��3������III������ȡ��Ϊ_____________
��4������IV�����Ʊ�����Cu2Oʱ��������Һ��pHΪ5��ԭ����_______________
A.  B.
B.  C.
C. 
�ڴ���Һ�з��������Cu2O�������ķ������з���Ҳ�ɷ���Cu2O����_________
��Cu2O����ķ�����_________________
��5��Ϊ�ⶨ��Ʒ��Cu2O�ĺ�������ȡ3.960g��Ʒ����ƿ�У�����30mL�����ữ��Fe2(SO4)3��Һ������������ַ�Ӧ����0.2000 mol��L��1��KMnO4��Һ�ζ����ظ�2��3�Σ�ƽ������KMnO4��Һ50.00mL��
�ٲ�Ʒ��Cu2O����������Ϊ_______
�����������ⶨ�������ƫ�ߵ�ԭ����_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��H2��g����F2��g��=2HF��g������Ӧ�����е������仯��ͼ��ʾ������˵����ȷ���ǣ�������

A.1 mol H2��1 mol F2��Ӧ����2 molҺ̬HF�ų�������Ϊ270 kJ
B.����������ֽ����������ͷ����ķ�Ӧ�Ƿ��ȷ�Ӧ
C.����ͬ�����£�1 mol H2��g����1 mol F2��g���������ܺʹ���2 mol HF��g��������
D.�����������䣬����������÷�Ӧ����H��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����dz�����ͬһԭ�ӹ�����˶��ģ����������෴��2�����ӣ���Ϊ�����Ӷ���������ͬһԭ�ӹ�����˶��ĵ������ӣ���Ϊ��δ�ɶԵ�����![]() �����й�����Ԫ��ԭ�ӵ���δ�ɶԵ�������˵�����������
�����й�����Ԫ��ԭ�ӵ���δ�ɶԵ�������˵�����������![]()
A.���������Ϊ�����Ļ�̬ԭ�ӣ���ԭ�ӹ����һ��������δ�ɶԵ�����
B.���������Ϊż���Ļ�̬ԭ�ӣ���ԭ�ӹ����һ��������δ�ɶԵ�����
C.ԭ�ӹ���к�����δ�ɶԵ������Ļ�̬ԭ�ӣ���������������Ϊż��
D.ԭ�ӹ���в�����δ�ɶԵ������Ļ�̬ԭ�ӣ�����������һ��Ϊż��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ���ֵ�����⡣��֪��CO(g)+H2O(g)H2(g)+CO2(g)ƽ�ⳣ�����¶ȵı仯���±���
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
�Իش��������⣺
��1����������Ӧ��________��Ӧ (��������������������)��
��2�����������ĸı��ܼӿ��䷴Ӧ���ʵ���_______(ѡ�����)��
�������¶ȣ��ڱ���������䣬ֻ����CO���������۱���������䣬����Neʹ��ϵѹǿ���ܱ���ѹǿ���䣬����Neʹ�������������
��3����һ�ݻ�Ϊ2L���ܱ������ڣ�����0.2molCO��0.4molH2��������ӦCO(g)+2H2(g) CH3OH(g)��CO��ƽ��ת�������¶ȣ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
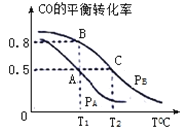
��A��B�����Ӧ��ѹǿ��С��ϵ��PA________PB��(����>������<������=��)
��A��B��C�����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵ�� ____________��
����P1ѹǿ��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=___________��
��4��T1�桢1L���ܱ������ڷ���������Ӧ�����ijʱ�̸����ʵ����ʵ������£�CO��0.1mol H2��0.2mol CH3OH��0.2mol����ʱv�� ____ v��(�� >��< �� =)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com