
(6分)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)ΔH=-1 160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(6分)1.60 NA(或1.6 NA) 173.4
【解析】
试题分析:根据盖斯定律,两式相加可得2 CH4(g)+4NO2(g)=== 2N2(g)+2CO2(g)+4H2O(g),ΔH=-1734kJ/mol,化简为CH4(g)+2NO2(g)=== N2(g)+CO2(g)+2H2O(g),ΔH=-867kJ/mol,若用标准状况下4.48 L CH4还原NO2至N2,甲烷的物质的量是4.48L/22.4L/mol=0.2mol,C元素化合价由-4价升高为+4价,失去8个电子,则0.2mol甲烷失去的电子的物质的量是1.6mol,即转移的电子总数是1.6NA;放出的热量是0.2mol×867kJ/mol=173.4kJ。
考点:考查盖斯定律的应用,氧化还原反应的计算


科目:高中化学 来源:2014-2015江苏省宿迁市五校高一上学期期中联考化学试卷(解析版) 题型:填空题
(10分)下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①、②均为工业上的重要反应。
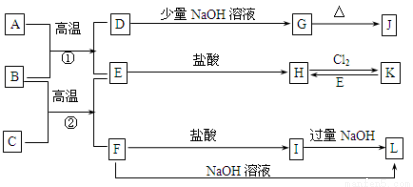
请回答下列问题:
(1)G是 ,K是 (填化学式)。
(2)C的原子结构示意图为 。
(3)写出B与C高温反应生成E和F的化学方程式: 。
(4)写出D与J的稀溶液反应生成G的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省蚌埠市高二上学期期中化学试卷(解析版) 题型:选择题
某烯烃与氢气加成后得到2,2-二甲基戊烷,烯烃的名称是
A.2,2-二甲基-3-戊烯 B.2,2-二甲基-4-戊烯
C.4,4-二甲基-2-戊烯 D.2,2-二甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省蚌埠市高一上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A、1mol任何物质都会有约6.02×1023个分子
B、物质的量既是物质的数量又是物质的质量
C、40gNaOH溶于1L水中,所得溶液浓度为1mol/L
D、气体的摩尔体积不一定是22.4L/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省蚌埠市高一上学期期中化学试卷(解析版) 题型:选择题
下列关于研究物质性质的基本程序,排列顺序正确是
a、观察物质的外观性质 b、实验和观察 c、解释及结论 d、预测物质的性质
A、bacd B、abcd C、adbc D、dabc
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省高二上学期第一次质量检测化学试卷(解析版) 题型:选择题
用铅蓄电池电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42——2e—==PbSO4
正极:PbO2+4H++SO42—+2e—==PbSO4+2H2O
若制得Cl20.050mol,电池内消耗的H2SO4的物质的量至少是
A、0.025mol B、0.050mol
C、0.10mol D、0.20mol
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省高二上学期第一次质量检测化学试卷(解析版) 题型:选择题
如图为某反应的焓变示意图,下列有关该反应的说法中正确的是

A.ΔH>0
B.X能量一定高于M
C.该反应为放热反应
D.该反应一定不必加热就可以发生
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高二上学期期中化学试卷(解析版) 题型:选择题
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)  4NO2(g)+O2(g) ΔH>0 ;T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH>0 ;T1温度下的部分实验数据为:
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol/ L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是
A.500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1 000 s时N2O5转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:填空题
(7分)(1)实验测得:在室温下1L水中只有10-7mol的水电离,列式计算水的电离平衡常数KH2O;
(2)已知水在25℃和100℃时,其电离平衡曲线如图所示,则25℃时水的电离平衡曲线应为_____(填“A”或“B”),请说明理由 。
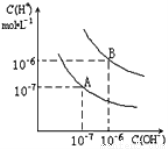
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com