
分析 根据n=$\frac{V}{Vm}$计算物质的量,根据总质量和总物质的量列式计算可得CO和CO2的质量,进而计算CO占总体积的比例.
解答 解:(1)标准状况下,Vm=22.4L/mol,n=$\frac{V}{Vm}$=$\frac{33.6L}{22.4L/mol}$=1.5mol,两种气体总的物质的量为1.5mol;设CO的物质的量为x,CO2的物质的量为y,
则有:x+y=1.5,28x+44y=62,解之得:x=0.25mol,y=1.25mol,$\frac{0.25}{1.25}$=$\frac{1}{6}$.
故答案为:1.5;1.25;$\frac{1}{6}$.
点评 本题考查混合物的计算,题目难度不大,注意相关物理量计算公式的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 (1)中国古代四大发明之一--黑火药,它的爆炸反应为S+3C+2KNO3$\frac{\underline{\;点燃\;}}{\;}$K2S+3CO2↑+N2↑.
(1)中国古代四大发明之一--黑火药,它的爆炸反应为S+3C+2KNO3$\frac{\underline{\;点燃\;}}{\;}$K2S+3CO2↑+N2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Cu2+、Na+、SO42- | |
| B. | 加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| C. | 强酸性溶液中:Fe2+、Al3+、NO3-、Cl- | |
| D. | 酚酞试液显红色的溶液中:Ba2+、Na+、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
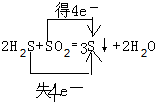 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性 | B. | 碱性 | C. | 氧化性 | D. | 还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液中加入过量NaOH溶液:HCO3-+OH-═H2O+CO2 | |
| B. | 向次氯酸钠溶液中通入少量二氧化碳:2ClO-+H2O+CO2═2HClO+CO32- | |
| C. | 向乙二酸(H2C2O4)溶液中滴入少量氢氧化钠溶液:H2C2O4+2OH-═C2O42-+2H2O | |
| D. | 向氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 该反应的化学方程式为3X(g)+Y(g)?2Z(g) | |
| C. | 25℃时,该反应的平衡常数为1600 | |
| D. | 改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com