
| A. | 参加反应的酸和碱的物质的量相等 | |
| B. | 参加反应的酸中的H+总量和碱中的OH-总量相等 | |
| C. | 反应后混合液的pH=7 | |
| D. | 不能用适当的酸碱指示剂来判断 |
分析 中和滴定时,滴定终点酸碱恰好反应,则参加反应的酸中的H+总量和碱中的OH-总量相等,反应后溶液不一定为中性,取决于酸碱的强弱,以此解答该题.
解答 解:A.恰好完全反应时,参加反应的酸和碱的物质的是按方程式的计量数之比反应,参加反应的酸和碱的物质的量不一定相等,故A错误;
B.在室温下进行中和滴定,酸和碱恰好完全反应时,参加反应的酸中的H+离子总量和碱中OH-离子总量相等,故B正确;
C.温下酸和碱恰好完全反应时,溶液的pH不一定等于7,如醋酸与NaOH溶液的反应,恰好反应时生成醋酸钠,醋酸根离子部分水解,溶液呈碱性,故C错误;
D.根据反应后溶液的酸碱性,可确定不同的酸碱指示剂,如碱性溶液可用酚酞,酸性溶液用甲基橙,故D错误.
故选B.
点评 本题考查了中和滴定的操作方法,为高频考点,题目难度不大,明确酸碱恰好中和反应的含义为解答关键,注意熟练掌握中和滴定操作方法,试题培养了学生的分析能力及化学实验能力.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 若增大压强,则物质Y的转化率减小 | |
| B. | 以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| C. | 若升高温度,X的体积分数增大,则该反应的△H>0 | |
| D. | 将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5mol | B. | 4.5mol | C. | 1.5mol | D. | 0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
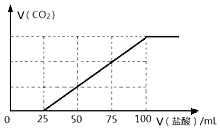 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.
向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
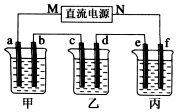 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液(NaHCO3),加热 | |
| B. | 铁粉(铝粉):加入过量的氨水后过滤 | |
| C. | NaCl溶液(Na2SO4):加入适量的硝酸钡后过滤 | |
| D. | 淀粉溶液(KCl):通过半透膜进行渗析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.5 | FeS沉淀完全 | 5.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com