
����Ŀ����(Co)���仯�����ڹ�ҵ���й㷺Ӧ�á�Ϊ��ij��ҵ�����л����ܣ�ijѧ�����������ͼ(�����к���Al��Li��Co2O3��Fe2O3������)��

��֪�������ܽ��ԣ�LiF������ˮ��Li2CO3����ˮ
��ش���
(1)���з�����Ӧ�Ļ�ѧ����ʽΪ______________________������������ԭ��Ӧ���ڷ���ʽ���õ����ű�ǵ���ת����_________________________���粻�Ǵ˲��ԡ�
(2)д���������Co2O3�����ᷴӦ����Cl2�����ӷ���ʽ��_____________________��
(3)�����е���Ҫ�ɷֳ���LiF�⣬����____________________��
(4)NaF����Һ�е�Li+�γ�LiF�������˷�Ӧ�Բ���������������___________________��
(5)�ڿ����м���10.98g�����ܾ���(CoC2O4��2H2O)��Ʒ�����ȹ����в�ͬ�¶ȷ�Χ�ڷֱ�õ�һ�ֹ������ʣ����������±�����֪��M(CoC2O4��2H2O)=183g/mol��
�¶ȷ�Χ/�� | ��������/g |
150��210 | 8.82 |
290��320 | 4. 82 |
890��920 | 4.5 |
���ⶨ�����ȵ�210��ʱ���������ʵĻ�ѧʽΪ__________________�����ȵ�210��290������в���������ֻ��CO2���˹��̷�����Ӧ�Ļ�ѧ����ʽ��_________________________���¶ȸ���890��ʱ�����������ֽⷴӦ���������Ϊ________________��
���𰸡� 2Al+2NaOH+2H2O= 2NaAlO2+3H2 �� ![]() Co2O3+6H++2Cl=2Co2++Cl2��+3H2O Fe(OH)3 ��ֹ����ӽ��̼��������γ�̼��﮳��� CoC2O4 3CoC2O4 +2O2 =Co3O4+6CO2 CoO
Co2O3+6H++2Cl=2Co2++Cl2��+3H2O Fe(OH)3 ��ֹ����ӽ��̼��������γ�̼��﮳��� CoC2O4 3CoC2O4 +2O2 =Co3O4+6CO2 CoO
����������1��Al�ڼ������������������Ʒ�Ӧ������������ƫ�����ƣ���ӦΪ��2Al+2NaOH+2H2O= 2NaAlO2+3H2 �������е����ű�ʾʱ��Ҫ�ij�6molˮ����Ӧ�е���������ˮ��![]() ��
��
��2������������������Һ���Ȼ���Ϊ���������ԭ���غ�͵����غ������ƽ��д���ӷ���ʽ����Ԫ�ػ��ϼ۽���Ϊ+2������Ԫ�ػ��ϼ۩�1�۱仯Ϊ0�ۣ���ӦΪ��Co2O3+ 6H++2Cl =2Co2++Cl2��+3H2O��
��3������pH��Ŀ����Ϊ��ʹ������ת��Ϊ���������������Ӷ���ȥ��Ԫ�����ʡ�
��4���ڲ��������γ�LiF���������Գ�ȥ����������ӣ������ڲ��������γ�̼��﮳������Ա�֤�õ���̼���ܵĴ��ȡ�
��5�����㾧�����ʵ���n=10.98��183=0.06mol��ʧȥ�ᾧˮӦΪ0.12mol�����������仯=0.12��18=2.16g��ͼ�����ݿ�֪��150����210�����������仯Ϊ10.98-8.82=2.16g��˵��210��ʧȥ�ᾧˮ�õ�CoC2O4��210����290����������CoC2O4������Ӧ������������ֻ��CO2 ������Ԫ���غ�õ�����CO2���ʵ���Ϊ0.12mol������Ϊ0.12��44=5.28g�����ǹ����������Ƽ�СΪ8.82g-4.82g=4g��˵��������μӷ�Ӧ���������ֻ��Ϊ��������Ӧ����������Ϊ5.28-4=1.28g��O2���ʵ���Ϊ1.28��32=0.04mol������n��CoC2O4����n��O2����n��CO2��= 3��2��6�����Է���ʽΪ��3CoC2O4 + 2O2 =Co3O4+6CO2���¶ȸ���890��ʱ�����������ֽⷴӦ���õ����������Ϊ4.5g�����к�����Ԫ�ص�����Ϊ0.06��59=3.54g�����Թ����к�����Ԫ�ص�����Ϊ0.96g�������ʵ���Ϊ0.06mol�����Ի�ѧʽΪCoO��


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������ȡ���κ����±(��Ҫ�ɷ�ΪNaCl)�Ʊ�����þ���乤���������£�����˵���У��������
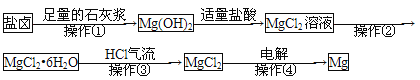
A. ����ʵ���ҽ��в�����ֻ��Ҫ©�����ձ����ֲ�������
B. ������������Ũ�������½ᾧ���ˡ�ϴ�ӵȲ���
C. ������ͨ��HCl������Ϊ������MgCl2��ˮ��
D. �������Ʊ������У�δ�����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��ʯ���ѽ�������Ҫ�ɷ֣������ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����һ�������£�������ת����

��1����ϩ�ĵ���ʽ��___________________��
��2��������������ϩ���ѽⷴӦ����_________________�����ѧ�������������仯��
��3����ϩת��Ϊ�Ҵ��ķ�Ӧ������__________________��
��4���Ҵ�ת��ΪA�Ļ�ѧ����ʽ��____________________________________________��
��5����ҵ����ϩͨ���ۺϷ�Ӧ�ɵõ��߷��ӻ�����B����Ӧ�Ļ�ѧ����ʽ��_____________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽֻ��ʾһ�����ʵ��ǣ�������
A.C2H6
B.C2H4O2
C.C2H6O
D.C2H4Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��һ�ֹ��ʹ��ϵĸ�Ч������������ClO2���ڣ�������
A.��
B.��
C.�����
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڵ������Һ����ȷ�ж��ǣ� ��
A.��pH=12����Һ�У�K+��Cl����HCO3����Na+���Թ���
B.ˮ�����c��H+��=1��10��3mol/L����Һ�У�Na+��Fe3+��SO42����Cl��
C.��0��l moI/L BOH��Һ��pH=10������֪BOH��Һ����BOH=B++OH��
D.![]() =1��10��13mol/L ����Һ�У�Ba2+��ClO����Cl����NO3��
=1��10��13mol/L ����Һ�У�Ba2+��ClO����Cl����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. þ�Ż�ʱ���ö�����̼��������
B. �ִ���ѧ����������,������һЩ������������ѧ���ʵ���ɡ�����ԭ�����չ���ȷ�������к�����Щ����Ԫ��
C. ������ͭ�������������ϸ������ͭת��Ϊͭ
D. ��������Ļ�ѧ���ʲ�����,����ǿ�Ӧ,�����κ��ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ж�Ӧ�ı仯����ͼ����ϵ���
ʵ����� | X | Y |
| |
A | ϡHCl�μӵ�NaOH��Һ�� | V(HCl) | N(Na+) | |
B | ���ۼ��� CuSO4��Һ�� | m(Fe) | m(�� ��) | |
C | CO2ͨ��NaOH��Һ�� | V(CO2) | ��Һ�ĵ������� | |
D | ϡH2SO4�μӵ� Ba(OH)2��Һ�� | V(H2SO4) | ��Һ�ĵ������� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ��������������W��Y����������֮��ΪX��������������2����Z�����������������ڲ��������X��Y��Z�ļ����ӵĵ��Ӳ�ṹ��ͬ��W�ĵ����ǿ��������������������塣����˵����ȷ����
A. Y�����������Գ�ˮ��������Ա�W��ǿ
B. W����̬�⻯���X���ȶ�
C. ���Ӱ뾶�Ĵ�С˳��r(w)>r(X)>r(Y)>(Z)
D. XY2��ZY2�еĻ�ѧ��������ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com