
 H2(g)+
H2(g)+ X2(g)?HX(g)的平衡常数为10.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
X2(g)?HX(g)的平衡常数为10.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( ) H2(g)+
H2(g)+ X2(g)?HX(g)的平衡常数为10,则相同条件下HX分解的化学反应的平衡常数为
X2(g)?HX(g)的平衡常数为10,则相同条件下HX分解的化学反应的平衡常数为 ,然后设出HX分解的物质的量,利用化学平衡三段法来计算各物质平衡时的浓度,然后利用平衡常数为
,然后设出HX分解的物质的量,利用化学平衡三段法来计算各物质平衡时的浓度,然后利用平衡常数为 来计算解答.
来计算解答. H2(g)+
H2(g)+ X2(g)?HX(g)的平衡常数为10,
X2(g)?HX(g)的平衡常数为10,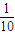 ,设HX分解的物质的量为x,则
,设HX分解的物质的量为x,则 H2(g)+
H2(g)+ X2(g)
X2(g) mol/L
mol/L  mol/L
mol/L  mol/L
mol/L mol/L
mol/L  mol/L
mol/L =
= ,
, ×100%=17%,
×100%=17%,

科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 1mol H2(g)和1mol I2(g)置于某1L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,达到平衡HI的体积分数w(HI)随时间变化如图(Ⅰ)所示.若改变反应条件,w(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是( )
1mol H2(g)和1mol I2(g)置于某1L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,达到平衡HI的体积分数w(HI)随时间变化如图(Ⅰ)所示.若改变反应条件,w(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 将1mol H2(g)和2molI2(g)置于2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?
将1mol H2(g)和2molI2(g)置于2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?查看答案和解析>>
科目:高中化学 来源: 题型:
 将1mol I2(g)和2mol H2置于5L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达到平衡.HI的体积分数w(HI)随时间变化如曲线(Ⅱ)所示:
将1mol I2(g)和2mol H2置于5L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达到平衡.HI的体积分数w(HI)随时间变化如曲线(Ⅱ)所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 已知298K时:
已知298K时:| c |
| 2 |
| c |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com