
【题目】过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
选项 | 二氧化碳 | 碳酸钠 | 转移的电子 |
A | 1mol | 2NA | |
B | 22.4L | 1mol | |
C | 106g | 1mol | |
D | 106g | 2NA |
【答案】C
【解析】
试题分析:设二氧化碳和过氧化钠反应,当固体质量增加28g时,参与反应二氧化碳的物质的量为x,生成碳酸钠的物质的量为y
2Na2O2+2CO2═2Na2CO3+O2 固体质量差
2mol 2mol 56g
x y 28g
![]() =
=![]() ,解之得:x=1mol,
,解之得:x=1mol,
![]() =
=![]() ,解之得:y=1mol,
,解之得:y=1mol,
碳酸钠的质量=1mol×106g/mol=106g,因常温常压下发生的反应,1mol二氧化碳的体积>22.4L;由化学方程式可知;1mol二氧化碳参与反应时消耗1mol过氧化钠,过氧化钠起氧化剂、还原剂作用,各占一半,故转移电子为1mol×![]() ×2=1mol,即有 NA个电子转移,由此可知上表中C正确;故选C。
×2=1mol,即有 NA个电子转移,由此可知上表中C正确;故选C。


科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。常见水处理剂还有高铁酸盐及ClO2,请回答下列问题:
(1)FeCl3可以用来刻蚀铜箔制造电路板,写出对应离子方程式 高铁酸盐是一种绿色净水剂,其有效成分是高铁酸根FeO42-。能消毒,且能净水。工业上常在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠,该反应的化学方程式为 。
(2)ClO2是一种高效、低毒的消毒剂,工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(3)漂白粉在工业中常用氯气通入石灰乳来制备,写出对应化学方程式 。在使用时将漂白粉溶于水配成溶液,放置一段时间即可使用,写出漂白粉工作原理的离子方程式 。氯水也具有漂白性,但是久置氯水因为发生了 反应而失去漂白性。
(4)描述实验室制备氢氧化铁胶体的方法 ,写出对应离子方程式 。
(5)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3
ClO3- + Fe2+ + ( ) = Fe3+ + Cl-+ ( )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g);
Y(g);![]() H=Q kJ·mol-1。温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
H=Q kJ·mol-1。温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
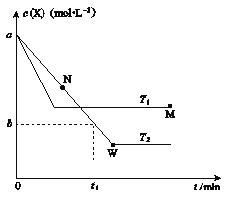
A.该反应进行到M点放出的热量小于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)=![]() mol·L-1·min-1
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“优化结构、提高效益和降低消耗、保护环境”,这是我国国民经济和社会发展的基础性要求。你认为下列行为不符合这个要求的是( )
A.将煤转化成气体燃料可以有效地减少“温室效应”的气体产生
B.加快太阳能、风能、生物质能、海洋能等清洁能源的开发利用
C.研制开发以水代替有机溶剂的化工涂料
D.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在在恒容的密闭容器中,能表示反应X (g) + 2Y (g)![]() 2Z (g)一定达到化学平衡状态的是:
2Z (g)一定达到化学平衡状态的是:
①X、Y、Z的物质的量之比为1:2:2
② X、Y、Z的浓度不再发生变化
③ 容器中的压强不再发生变化
④ 单位时间内生成n molZ,同时生成2n molY
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )
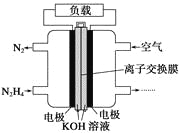
A. 电流从右侧电极经过负载后流向左侧电极
B. 负极发生的电极反应式为N2H4+4OH--4e-===N2↑+4H2O
C. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D. 该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,虽然和食盐很像,但有毒,不能食用。以下为亚硝酸钠的工业生产流程:
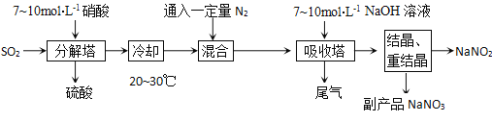
(1)首先在反应塔中通SO2和淋入硝酸,控制反应生成的NO与NO2物质的量之比恰好1:1,则分解塔中发生反应的化学方程式为: 。试从产物产率的角度分析该反应中硝酸的浓度不宜过大或过小的原因是 。
(2)吸收塔中所发生化学反应方程式为: 。
(3)为测定亚硝酸钠的含量,称取4.500 g样品溶于水配成250 mL溶液,取20.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

①锥形瓶中发生反应的离子方程式为 。
②第一组实验数据出现异常,造成这种异常的原因可能是_________(填代号)。
A.酸式滴定管用蒸馏水洗净后用标准液润洗
B.滴定终点时仰视读数
C.锥形瓶洗净后未干燥
③根据表中数据,计算所得固体中亚硝酸钠的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)![]() CH3OH(g)。在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g)。在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
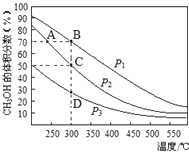
A.该反应的△H<0,且p1<p2<p3
B.在C点时,H2转化率为75%
C.反应速率:ν逆(状态A)>ν逆(状态B)
D.在恒温恒压条件下,向该密闭容器中再充入1molCH3OH,达平衡时CH3OH的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.烧碱、冰醋酸、四氯化碳均为电解质
B.胆矾、冰水混合物、四氧化三铁都不是混合物
C.分离胶体和某盐溶液,可用过滤的方法
D.SO2、SiO2、CO均为酸性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com