
����Ŀ���������������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ����Ӧ�õ��������߿Ƽ�����
��1����֪�����ڽ���Ԫ��A��B���䵥�ʵ�λ������ȼ���ȴ�����ȼ�ϣ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
�����ܣ�kJ/mol�� | I1 | I2 | I3 | I4 |
A | 899.5 | 1757.1 | 14848.7 | 21006.6 |
B | 738 | 1451 | 7733 | 10540 |
�ٸ����������ݷ�����B�����ڱ���λ�����������ӦΪ��
����ijͬѧ��Bԭ�ӵĻ�̬��Χ�����Ų�ʽд����ns1np1 �� Υ����ԭ����
��BԪ�صĵ�һ�����ܴ���Al��ԭ������
��2��������Ϊһ�������Դ�����������Ĵ������⣬C60������������ϣ�����֪���ʯ�е�C��C�ļ���Ϊ154.45pm��C60��C��C����Ϊ145��140pm����ͬѧ�ݴ���ΪC60���۵���ڽ��ʯ������Ϊ�Ƿ���ȷ���������� ��
��C60������ÿ��̼ԭ��ֻ�����ڵ�3��̼ԭ���γɹ��ۼ�����ÿ��̼ԭ������㶼����8��������ȶ��ṹ����C60�����ЦҼ���м�����Ŀ֮��Ϊ ��
���𰸡�
��1��s��+2�ۣ�������ͣ�þԭ��3s���ȫ�����������ϵ�
��2������ȷ��C60�Ƿ��Ӿ��壬�ۻ�ʱ�����ƻ���ѧ����3��1
���������⣺��1������A��B��ԭ�ӵĵڶ�����������֮�䶼��1��ͻԾ��˵���������ڢ�A�壬�����Ƕ��Ƕ�����Ԫ�أ���A�ĵ�һ�����ܱ�B�����AΪBeԪ�أ�BΪMgԪ�أ���MgԪ��������s����3S2 �� Ϊs��Ԫ�أ������2�����ӣ���+2�ۣ��ʴ�Ϊ��s��+2�ۣ�����Bԭ�ӵĻ�̬��Χ�����Ų�ʽд����ns1np1 �� ��֪��3s�ܼ�δ���������3p�ܼ���3s�ܼ�������3p�ܼ��ͣ�����Υ���������ԭ�����ʴ�Ϊ���������ԭ��������ΪMg�ļ۵����Ų�ʽ��3s2 �� 3S���ȫ�����������ϵͣ���Al��3s23p1 �� ���Ե�һ�����ܣ�Mg��Al���ʴ�Ϊ��þԭ��3S���ȫ�����������ϵͣ���2������ΪC60���ɵľ����Ƿ��Ӿ��壬Ӱ����Ӿ����۵�������Ƿ��Ӽ��������������ʯ���ɵľ�����ԭ�Ӿ��壬Ӱ��ԭ�Ӿ����۵��������ԭ�Ӽ乲�ۼ������ۼ����ô������Ӽ�����������˽��ʯ���۵����C60 �� ���Ծ���C60��C��C���ļ��ܿ��ܴ��ڽ��ʯ�������ۻ�ʱ�����ƻ���ѧ������˱Ƚϼ���û�����壬�ʴ𰸣�����ȷ��C60�Ƿ��Ӿ��壬�ۻ�ʱ�����ƻ���ѧ���� ��C60������ÿ��ԭ��ֻ�����ڵ�3��ԭ���γɹ��ۼ�����ÿ��ԭ������㶼����8�����ȶ��ṹ����ÿ��C�γɵ���3�����У���Ȼ��1��˫��������ÿ��Cԭ������������8�����ȶ��ṹ��˫����Ӧ����Cԭ������һ�룬��˫������1���Ҽ���1���м�����Ȼ�м���ĿΪ30��һ��C�����ߵ�3��C�γɹ��ۼ���ÿ�����ۼ�ֻ��һ���������Cԭ�ӣ����ԦҼ�Ϊ ![]() +30=90����C60�����ЦҼ���м�����Ŀ֮��Ϊ90��30=3��1���ʴ�Ϊ��3��1�� ��1������A��B��ԭ�ӵĵڶ�����������֮�䶼��1��ͻԾ�����Ƕ��Ƕ�����Ԫ����֪Ԫ��A��Ԫ��B���ٸ���Ԫ��ԭ�ӵ���Χ�����Ų����������ɽ�Ԫ�����ڱ��ֳ��������s����p����d����ds����f����BΪMgԪ�������ڱ���λ��S���������ӦΪ+2�ۣ����ɻ�̬��Χ�����Ų�ʽ��֪��3s�ܼ�δ���������3p�ܼ�����3s�ܼ�������3p�ܼ��ͣ���ͬ���ڴ����ҵ�һ����������IIA��IIIA��������2���ٸ��ݷ��Ӿ�����۵��빲�ۼ��ļ����ط�������C60������ÿ��ԭ��ֻ�����ڵ�3��ԭ���γɹ��ۼ�����ÿ��ԭ������㶼����8�����ȶ��ṹ����ÿ��C�γɵ���3�����У���Ȼ��1��˫��������ÿ��Cԭ������������8�����ȶ��ṹ��˫����Ӧ����Cԭ������һ�룬����Ϊ�Ҽ���˫������1���Ҽ���1���м���
+30=90����C60�����ЦҼ���м�����Ŀ֮��Ϊ90��30=3��1���ʴ�Ϊ��3��1�� ��1������A��B��ԭ�ӵĵڶ�����������֮�䶼��1��ͻԾ�����Ƕ��Ƕ�����Ԫ����֪Ԫ��A��Ԫ��B���ٸ���Ԫ��ԭ�ӵ���Χ�����Ų����������ɽ�Ԫ�����ڱ��ֳ��������s����p����d����ds����f����BΪMgԪ�������ڱ���λ��S���������ӦΪ+2�ۣ����ɻ�̬��Χ�����Ų�ʽ��֪��3s�ܼ�δ���������3p�ܼ�����3s�ܼ�������3p�ܼ��ͣ���ͬ���ڴ����ҵ�һ����������IIA��IIIA��������2���ٸ��ݷ��Ӿ�����۵��빲�ۼ��ļ����ط�������C60������ÿ��ԭ��ֻ�����ڵ�3��ԭ���γɹ��ۼ�����ÿ��ԭ������㶼����8�����ȶ��ṹ����ÿ��C�γɵ���3�����У���Ȼ��1��˫��������ÿ��Cԭ������������8�����ȶ��ṹ��˫����Ӧ����Cԭ������һ�룬����Ϊ�Ҽ���˫������1���Ҽ���1���м���


 �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������ƿʧȥ��ǩ����Һ������һƿ��KHSO4��Һ����һƿ��KOH��Һ������ʱ������ѡ�õ���ֽ���Լ�����ȷ���ǣ� ��
A.pH��ֽ
B.��ɫʯ����Һ
C.K2CO3����
D.KCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö��Ե缫���2L 1molL��1������ͭ��Һ���ڵ�·��ͨ��0.5mol���Ӻ���Դ���ӣ���·����ͨ��1mol���ӣ���ʱ��Һ��c��H+���ǣ�����Һ������䣩�� ��
A.1.5 molL��1
B.0.5 molL��1
C.0.75 molL��1
D.0.25 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش��ȼҵ���������⣺
��1���������ռ��ǵ��ʳ��ˮʱ���չ̶��ı���k�������ȣ����ɵIJ�Ʒ��������k=
��2��ԭ�ϴ����г�������ɳ��Ca2+��Mg2+��Fe3+��SO42�������ʣ����뾫�ƺ���ܹ����ʹ�ã�����ʱ����������ˮ���˺�Ҫ������Լ��ֱ�Ϊ��Na2CO3�������� ��BaCl2 �� �������Լ����ӵĺ���˳����������ţ�
��3���ȼҵ�Ǹߺ��ܲ�ҵ��һ�ֽ�������ȼ�ϵ������ϵ��¹��տ��Խ���30%���ϣ������ֹ�������У�������ϵĴ�����ת����ϵ��ͼ��ʾ�����еĵ缫δ��������õ�����Ĥ��ֻ����������ͨ���� 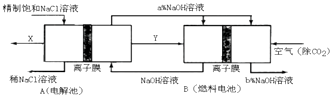
��ͼ��X��Y�ֱ��������ѧʽ���������Ƚ�ͼʾ������������������a%��b%�Ĵ�С ��
�ڷֱ�д��ȼ�ϵ��B�������������Ϸ����ĵ缫��Ӧ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������з�Ӧ�У�
A��2F2+2H2O=4HF+O2
B��2Na+2H2O=2NaOH+H2��
C��3NO2+H2O=2HNO3+NO D��2H2O![]() 2H2��+O2��
2H2��+O2��
����ˮֻ������������__________��ˮֻ����ԭ������__________��ˮ����������������ԭ������__________��ˮ�Ȳ����������ֲ�����ԭ������________
��2��������ˮ�к��ж��ֳɷ֣�����ɫʯ����Һ������ˮ�У���Һ�Ժ�ɫ�������õijɷ���_________________����һ�������Һ����ɫ����ȥ�������õijɷ���_________________������ˮ�е�����������Һ��������ɫ�����������õijɷ���_____________����ˮ��ʹ���۵⻯����ֽ�����������õijɷ���_____________��
��3���������Ķ�����̼����ͨ���ռ���Һ�У�Ȼ��Ӧ�����Һ�ֳɶ��ȷݣ��ֱ������������Һ���ʵ����ʵ��������ᡢ����������Һ����ֱ�д��������Ӧ�����ӷ���ʽ��
��____________________________________________________________��
��____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���������ռ��������ǣ���������
A. 18g H2O B. 6.02��1023�������� C. 44.8L HCl D. 6g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ������ij���廯ѧ���ʵ�ʵ��װ�ã�ͼ��BΪ���ء� ���ȴ�B����A��ͨ�����������C�к�ɫ������ɫ�ޱ仯�����ر�Bʱ��C����ɫ������ɫ��ȥ����Dƿ��ʢ�е���Һ������ ����
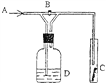
A. ŨH2SO4 B. ŨNaOH��Һ
C. ����Na2SO4��Һ D. ʯ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ʵ���Ũ�ȵ���Һ�����Ũ��ƫ�ߵIJ�����
A.ϴ�Ӻ������ƿδ����B.��Һ��δϴ���ձ��Ͳ�����
C.����ʱ���۾����߸��ӿ̶���D.��Һʱ��������Һ������ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǽס��ҡ�����λͬѧ��ȡ���������Ĺ��̣�������벢Э������������ʵ������ʵ��Ŀ�ġ���ȡ��������
��1����ʵ��ԭ�����ס��ҡ�����λͬѧ����ȡ�Ҵ���������Ũ�����Ϲ��ȵķ�����ȡ�����������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2����װ����ơ��ס��ҡ�����λͬѧ�ֱ��������������ʵ��װ�ã�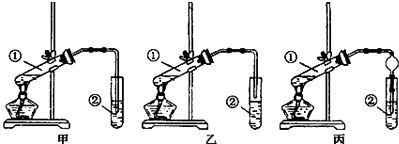
���Ӽס�����λͬѧ��Ƶ�װ����ѡ��һ����Ϊʵ������ȡ����������װ�ã�ѡ���װ��Ӧ������ס����ҡ�������ͬѧ����װ���еIJ����ܸij������θ���ܣ��������������⣬��һ��Ҫ������ ��
��3����ʵ�鲽�衿A����ѡ���װ����װ���������Թܢ����ȼ���3mL95%���Ҵ�������ҡ���»�������2mLŨ������ҡ�ȣ���ȴ���ټ���2mL�����
B���Թ̶ܹ�������̨�ϣ�
C���Թܢ��м���5mL X�Լ���
D�þƾ��ƶ��Թܢټ���
E�����۲쵽�Թܢ�������������ʱֹͣʵ�飮
���������ۡ�
��ʵ����Ũ����������� ��
���Թ�2�м����X�Լ�Ϊ ��
�۲���E�Թܢ��й۲쵽�������� ��
�ܳ�������������ʵ���е�����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com