
【题目】如何降低大气中CO2的含量及有效地开发利用碳资源的研究越来越紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
如表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H ________0 ( 填“>”、 “ < “ 或 “ = ”) ;
②判断反应达到平衡状态的依据是________.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
③借助上表数据判断,要提高CO的转化率,可采取的措施是________.
A.升温 B.充入更多H2 C.分离出甲醇 D.加入催化剂
(2)CH3OH可以用做燃料电池的燃料,以甲醇与氧气的反应为原理设计,现有电解质溶液是KOH溶液的燃料电池。请写出该电池负极的电极反应式:____________________.
(3)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=________________。
【答案】< BD BC CH3OH+8OH-6e-=CO32-+6H2O 2.5×10-9
【解析】
(1)①由表中数据可知,随着温度的升高,平衡常数减小,说明平衡逆向移动,正反应是放热反应,则ΔH<0,故答案为:<;
②A.生成CH3OH的速率与消耗CO的速率相等均表示正反应速率,不能说明反应达到平衡状态,A错误;
B.混合气体的质量始终不变,建立平衡的过程中混合气的物质的量减小,混合气的平均相对分子质量增大,所以混合气体的平均相对分子质量不变可以说明反应达到平衡状态,B正确;
C.混合气体的质量始终不变,容积不变,则混合气体的密度始终不变,混合气体的密度不变不能说明反应达到平衡状态,C错误;
D.CH3OH、CO、H2的浓度都不再发生变化说明反应达到平衡状态,D正确;
故答案选BD;
③根据表中数据可知随着温度的升高,平衡常数减小,这说明正反应是放热反应。又因为正反应是体积减小的可逆反应,则要提高CO的转化率:
A.升高温度平衡向逆反应方向进行,CO转化率降低,A不符合题意;
B.充入氢气,平衡正向进行,CO转化率增大,B符合题意;
C.分离出甲醇,平衡正向进行,CO转化率增大,C符合题意;
D.加入催化剂不能改变平衡状态,CO的转化率不变,D不符合题意;
故答案选BC;
(2)碱性条件下,CH3OH作燃料电池的负极,发生氧化反应,失去电子变成CO32-,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(3)根据方程式可知该反应的平衡常数K=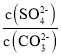 =
=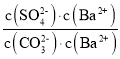 =
=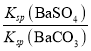 =4.0×10-2,所以BaCO3的溶度积Ksp=
=4.0×10-2,所以BaCO3的溶度积Ksp=![]() =2.5×10-9,故答案为:2.5×10-9。
=2.5×10-9,故答案为:2.5×10-9。


科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产、生活等方面有广泛的应用。
(1)铝元素位于周期表中第________周期________族。硼、镓与铝位于同一主族,现有下列三种物质:①NaAlO2、②NaBO2、③NaGaO2,浓度相同的这三种物质的溶液pH由大到小的顺序为________(用序号表示)。
(2)将20.0 mL 0.1 mol·L-1 Ba(OH)2溶液和20.0 mL 0.1 mol·L-1 NH4Al(SO4)2溶液混合,所得溶液中Al3+、NH![]() 、SO
、SO![]() 、OH-、H+的浓度由大到小的顺序为________________________。
、OH-、H+的浓度由大到小的顺序为________________________。
(3)氮化铝(AlN)是一种新型的无机非金属材料,可用作热交换器材料。某AlN样品中仅含有Al2O3杂质,为测定AlN的含量,甲组同学设计了如下流程:

已知:AlN+NaOH+H2O=NaAlO2+NH3↑。
①过滤时用到的玻璃仪器有烧杯、漏斗和________。
②实验过程中,称得样品的质量为4.2 g,最后得到的固体为5.1 g,则样品中AlN的质量分数为________。(不考虑整个过程中的损耗)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. ![]() 的溶液中:K+、Na+、CO32-、NO3-
的溶液中:K+、Na+、CO32-、NO3-
B.澄清透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
C.c(Fe2+)=1 mol/L的溶液中: Na+、NH4+、AlO2-、SO42-
D.能使甲基橙变红的溶液中: K+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
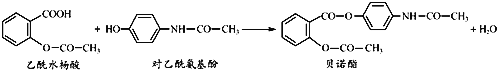
下列有关叙述正确的是
A.贝诺酯分子中有三种含氧官能团
B.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
C.乙酰水杨酸和对乙酰氨基酚均能与Na2CO3溶液反应放出CO2气体
D.可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯化硫(S2Cl2)是一种重要的有机合成氯化剂,实验室和工业上都可以用纯净干燥的氯气与二硫化碳反应来制取(CS2+3Cl2![]() CCl4+S2Cl2),其装置如下:
CCl4+S2Cl2),其装置如下:
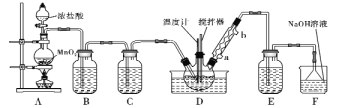
(1)A装置中的离子反应方程式为 ________________________________________________。
(2)一氯化硫(S2Cl2)常温下为液态,较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体,而且还有两种气体,用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl。 写出一氯化硫与水反应的化学反应方程式:____________________________。
(3)C、E装置中所盛溶液为__________。
(4)D中冷凝管的冷水进水口为____(填“a”或“b”);实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的方程式正确的是
A.电解氯化镁溶液:2Cl–+2H2O![]() H2↑+Cl2↑+2OH–
H2↑+Cl2↑+2OH–
B.碳酸氢铵溶液中加入足量石灰水:Ca2++![]() +OH–=CaCO3↓+H2O
+OH–=CaCO3↓+H2O
C.Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.氢氧化钡溶液中加入稀硫酸:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫的化合物合成、应用以及对环境的影响一直是科学界研究的热点。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
请回答:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
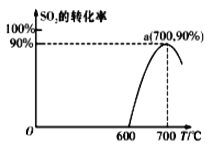
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=_______molL-1min-1,该温度下的平衡常数为_________.
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率________90%(填“>”、“<”或“=”).
③下列说法一定能说明该反应达到平衡状态的是_______.
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.

石墨I附近发生的反应为__________________________________,当外电路通过1mole-,正极上共消耗_______mol N2O5 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的,从海水中提取的MgCl2制得Mg和Cl2,进一步联合用金红石(主要成分TiO2)冶炼金属钛,工业上其主要的生产流程如下:
|
回答下列问题:
(1)加入过量试剂①后,能够分离得到Mg(OH)2沉淀的方法操作1用到的玻璃仪器有________________________________________;试剂②可以选用______。
(2)要得到MgCl2·6H2O的操作2名称是___________________________________。
(3)工业上冶炼金属钛的上述生产流程,其第1步是在高温下向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体,写出这步反应的化学方程式:____________________________。
(4) 工业上冶炼金属钛的上述生产流程,其第2步是在稀有气体氛围和加热的条件下,用镁与TiCl4反应得到钛,写出这步反应的化学方程式____________________,该反应时稀有气体氛围的作用是_____________________________________,该反应的金属冶炼方法属于是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
A | |||||||||
C | D | ||||||||
B | E | F | |||||||
(1)画出D的原子结构示意图________ ;
(2)A和F两种元素组成的化合物中含有的化学键是_____(填“共价”或“离子”)键。;
(3)E和F分别形成的气态氢化物中最稳定的是_________(填写氢化物的化学式)
(4)B的最高价氧化物的水化物的化学式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com