
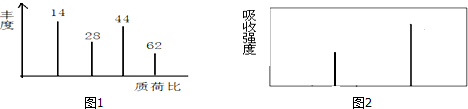
分析 (1)根据质荷比可知,有机物A的相对分子质量;
(2)根据n=$\frac{m}{M}$计算生成的水的物质的量,计算碳元素、氢元素的质量,根据质量守恒判断有机物A是否含有氧元素,若含有氧元素,计算氧元素质量、氧原子物质的量,根据原子守恒确定有机物A中C、H、O原子个数比值确定最简式;
(3)由核磁共振氢谱可知,该有机物分子中有2中化学环境不同的H原子,2种H原子数目之比为2:1,结合有机物的分子式确定其可能的结构;
(4)分子量为28的气态烃是C2H4,乙烯和氯气发生加成反应再水解生成乙二醇.
解答 解:(1)在A的质谱图中,最大质荷比为62,所以其相对分子质量也是62,故答案为:62;
(2)3.1g有机物燃烧生成0.1mol CO2,?2.7g水,
则n(C)=n( CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,n(H)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,
则m(C)+m(H)=1.2g+0.3g=1.5g<3.1g,故有机物含有O元素,且m(O)=3.1g-1.5g=1.6g,故n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,
n(C):n(H):n(O)=0.1mol:0.3mol:0.1mol=1:3:1,即该有机物最简式为CH3O,
故答案为:CH3O;
(3)根据相对分子质量是62,最简式为CH3O,有机物的分子式为C2H6O2,由核磁共振氢谱可知,该有机物分子中有2中化学环境不同的H原子,2种H原子数目之比为2:1,有机物A的分子式为C2H6O2,故该有机物结构式为CH2OHCH2OH,
故答案为:CH2OHCH2OH;
(4)分子量为28的气态烃是C2H4,乙烯和氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷水解生成乙二醇,
故答案为:加成反应→取代反应.
点评 本题考查有机物分子式与结构确定等,难度中等,注意燃烧法利用原子守恒确定有机物的分子式,侧重对基础知识与学生综合能力考查,注意对有机谱图的简单认识.


科目:高中化学 来源: 题型:选择题
| A. | 22.4 L氧气中,一定含有2mol氧原子 | |
| B. | 80 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L | |
| C. | 18 g水在标准状况下的体积约为22.4L | |
| D. | 标准状况下,20 mLNH3跟60 mLO2所含分子个数比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤⑦ | B. | ①⑤⑦⑧ | C. | ①⑤⑥ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学在实验室进行实验研究化学反应速率的影响因素.
某同学在实验室进行实验研究化学反应速率的影响因素.浓 度 反应条件 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加 热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径依次增大 | B. | 离子半径依次增大 | ||
| C. | 单质的密度依次逐渐增大 | D. | 氢氧化物的碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:MgO>NaCl>KCl | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol由元素A、B组成的化合物一定含有18mole- | |
| B. | 化合物AE与DE3有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素D的最高价氧化物对应的水化物可以溶于过量的氨水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com