
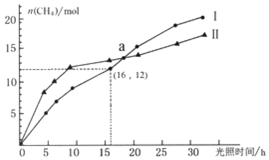
 可利用如下反应将二氧化碳转化为甲烷:CO2(g)+2H2O(g)?CH4(g)+2O2(g)△H=+802KJ/mol,右图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线.下列说法正确的是( )
可利用如下反应将二氧化碳转化为甲烷:CO2(g)+2H2O(g)?CH4(g)+2O2(g)△H=+802KJ/mol,右图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线.下列说法正确的是( )| A. | 0-15h内,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好 | |
| B. | 反应开始后的30h内,第Ⅰ种催化剂的作用下,反应吸收的热量多 | |
| C. | a点时,CO2的转化率相等 | |
| D. | 0-16h内,v(O2)=1.5mol/(L•h) |
分析 A.在0-15h时,在催化剂I的作用下,生成的甲烷的物质的量较少;
B、根据图象不难看出,在反应开始后的30h内,第Ⅰ种催化剂的作用下,得到的CH4较多;
C、二氧化碳初始浓度不同,但二氧化碳的变化量相同;
D.未指明是曲线Ⅰ还是曲线Ⅱ.
解答 解:A、在0-15h时,在催化剂I的作用下,生成的甲烷的物质的量较少,故催化剂ⅠI的催化效果比催化剂的效果好,故A错误;
B、根据图象不难看出,在反应开始后的30h内,第Ⅰ种催化剂的作用下,得到的CH4较多,所以第Ⅰ种催化剂的作用下,反应吸收的热量多,故B正确;
C、二氧化碳初始浓度不同,但二氧化碳的变化量相同,所以a点时,CO2的转化率不相等,故C错误;
D、未指明是曲线Ⅰ还是曲线Ⅱ,所以无法求速率,故D错误;
故选B.
点评 本题考查根据图象来分析计算化学反应速率以及分析催化剂对化学平衡常数的影响,难度不大,根据图象来提取有效信息是关键.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.3mol | B. | 小于0.15mol | C. | 0.15~0.3mol | D. | 0.15mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤 | B. | 蒸发 | C. | 分液 | D. | 分馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲基中含有电子数为10NA | |
| B. | 常温下,1LpH=12的Na2CO3溶液中含有的OH-离子数为0.01 NA | |
| C. | 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA | |
| D. | 50mL12mol•L-1盐酸和足量MnO2共热,转移的电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的大量排放会导致酸雨的形成 | |
| B. | 黄河三角洲的形成体现了胶体聚沉的性质 | |
| C. | 推广使用燃料电池汽车,可减少颗粒物、CO等有害物质的排放 | |
| D. | 轮船上挂锌锭防止铁腐蚀,属于牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X>W>Q | |
| B. | Q、X形成的化合物的电子式为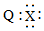 | |
| C. | 最简单氢化物的稳定性:Z>W | |
| D. | 工业上常用电解的方法制备X、Y的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com