
把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡: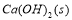

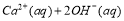 ,下列说法正确的是( )
,下列说法正确的是( )
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的强
B.一定温度下,可逆反应2X (g)+Y (g)  2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2
2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2
C.升高温度,AgCl的溶解度增大,Ksp增大
D.FeCl3 、KAl(SO4)2、Na2CO3的水溶液均显酸性
查看答案和解析>>
科目:高中化学 来源:2015届江西赣州市高二上学期期末联考化学试卷(解析版) 题型:填空题
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
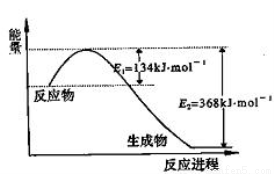
(1)上图是1 mol NO2气体和1 mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
已知:N2 (g)+2NO2 (g)  4NO(g) △H=+292.3kJ·mol—1,
4NO(g) △H=+292.3kJ·mol—1,
则反应: 2NO(g)+2CO(g) N2(g)+2CO2(g) 的△H= ;
N2(g)+2CO2(g) 的△H= ;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20 mol NO2和5 mol O2发生反应: 4NO2(g)+O2(g) 2N2O5(g);已知体系中n(NO2)随时间变化如下表:
2N2O5(g);已知体系中n(NO2)随时间变化如下表:
t(s) | 0 | 500 | 1000 | 1500 |
n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
①写出该反应的平衡常数表达式:K= ,已知:K3000C>K3500C,则该反应是 反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为 ,若要增大NO2的转化率,可采取的措施有
A.降低温度
B.充入氦气,使体系压强增大
C.再充入NO2
D.再充入4 mol NO2和1 mol O2
③图中表示N2O5的浓度的变化曲线是 ,用O2表示从0~500s内该反应的平均速率v= 。

查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:填空题
据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H= -359.8 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ?△H= -556.0 kJ·mol-1
③ H2O(g)=H2O(l)? △H= -44.0 kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:选择题
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )

A.0.15 mol CuO B.0.1 mol CuCO3
C.0.075mol Cu(OH)2 D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:选择题
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH-)增大
②溶液的pH<7
③溶液中c(Na+)=c(A2-)
④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
A.①②④ B.①③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高二上学期期末考试化学试卷(解析版) 题型:实验题
用0.1320 mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 22.60 |
回答下列问题:
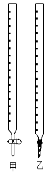
(1)图中甲为 滴定管,乙为 滴定管(填“酸式”或“碱式 ”);
(2)取待测液NaOH溶液25.00 mL 于锥形瓶中,使用 做指示剂,滴定终点的判断依据是 ;
(3)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果 (填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果 ;
(4)该NaOH溶液的物质的量浓度为 mol/L (保留小数点后四位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高二上学期期末考试化学试卷(解析版) 题型:选择题
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是
A.自来水 B.0.5 mol·L-1盐酸
C.0.5 mol·L-1 CH3COOH溶液 D.0.5 mol·L-1 KCl溶液
查看答案和解析>>
科目:高中化学 来源:2015届江苏省扬州市高二下学期学业水平模拟化学试卷(二)(解析版) 题型:选择题
下列各组离子在溶液中能大量共存的是
A.Cu2+、Mg2+、SO42-、NO3- B.H+、Mg2+、SO42-、ClO-
C.Ag+、Na+、NO3-、Cl- D.NH4+、Ba2+、NO3-、OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com