
【题目】(1)等体积等物质的量浓度的盐酸和氨水溶液混合后,溶液呈_____(填“酸性”,“中性”或“碱性”),溶液中c(H+)_____ c(OH—)+c(NH3·H2O)(填“>”或“=”或“<”)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH—)=_______mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)=__________mol/L,由水电离产生的c(H+)=_______mol/L,此时温度_______25℃(填“高于”、“低于”或“等于”)。
【答案】酸性 = 2.0×10-7 8×10-11 8×10-11 高于
【解析】
(1)将物质的量浓度相同的盐酸与氨水等体积混合后,恰好完全反应生成氯化铵,根据盐类水解的规律结合守恒规律分析解答;
(2)纯水显中性,故溶液中的c(H+)=c(OH-),据此分析;若温度不变,则水的离子积不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,据此求出c(OH-)=![]() ,而由水电离出的c(H+)=c(OH-);温度越高,水的离子积数值越大,据此分析判断。
,而由水电离出的c(H+)=c(OH-);温度越高,水的离子积数值越大,据此分析判断。
(1)等体积等物质的量浓度相同的盐酸与氨水混合后,盐酸与氨水恰好完全反应生成氯化铵,铵根离子水解,溶液显酸性,c(H+)>c(OH-);根据质子守恒,溶液中c(H+)=c(OH-)+c(NH3·H2O),故答案为:酸性;=;
(2)某温度下,纯水中的c(H+)= c(OH-)=2.0×10-7mol/L;若温度不变,Kw= c(H+) c(OH-)=4.0×10-14mol/L,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)=![]() =8.0×10-11mol/L,水的电离受到抑制,在酸溶液中,所有的氢氧根全部来自于水的电离,而由水电离出的c(H+)=c(OH-),由水电离产生的c(H+)=8.0×10-11mol/L,水的电离为吸热过程,温度越高,水的离子积数值越大,故此温度高于25℃,故答案为:2.0×10-7;8×10-11;8×10-11;高于。
=8.0×10-11mol/L,水的电离受到抑制,在酸溶液中,所有的氢氧根全部来自于水的电离,而由水电离出的c(H+)=c(OH-),由水电离产生的c(H+)=8.0×10-11mol/L,水的电离为吸热过程,温度越高,水的离子积数值越大,故此温度高于25℃,故答案为:2.0×10-7;8×10-11;8×10-11;高于。


科目:高中化学 来源: 题型:
【题目】(1)严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:用活性炭处理尾气时还可发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
时间/min 浓度/mol·L1 | 0 | 5 | 10 | 15 | 20 | 25 |
NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 |
15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是____(填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
(2)750K下,在恒容密闭容器中,充入一定量的甲醇,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)某温度,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。
①若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)________v(逆)(填“>”“<”或“=”)。在其他条件不变的情况下,再增加2 mol CO与5 mol H2,达到新平衡时,CO的转化率________(填“增大”“减小”或“不变”)。
②下列不能说明该反应已达到平衡状态的是________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变
c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
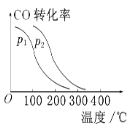
③在一定压强下,容积为V L的容器充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。则p1________p2(填“大于”“小于”或“等于”,下同),ΔH________0。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的一氯取代物只有4种
B.用系统命名法命名有机物A,名称为2,2,3三甲基戊烷
C.有机物A的分子式为C8H18
D.B的结构可能有3种,其中一种名称为3,4,4三甲基2戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种白色固体,常用作杀菌剂、防腐剂。
(1)化学实验小组选用如下装置(部分固定装置略)用钙和氧气制备过氧化钙。

①请选择必要的装置(装置可重复使用),按气流方向连接顺序为__________________。(填仪器接口的字母编号)
②连接好装置进行实验,步骤如下:
I.检查装置气密性后,装入药品;
II._____________________;
III.点燃B处酒精灯加热药品;反应结束后,_______________________________;
Ⅳ.拆除装置,取出产物。
(2)已知化学反应Ca2++H2O2+2NH3+8H2O= CaO2·8H2O↓+2NH4+。在碱性环境中制取CaO2·8H2O的装置如下图:
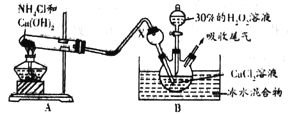
①装置B中仪器X的作用是__________________________________;反应在冰水浴中进行的原因是__________________________________________________________。
②反应结束后,经________、__________、低温烘干获得CaO2·8H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关①100mL 0.1 mol/L![]() 、②100mL 0.1 mol/L
、②100mL 0.1 mol/L![]() 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中水电离出的![]() 个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:![]() D.②溶液中:
D.②溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,各反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g),K=1×10-30;
2NO(g),K=1×10-30;
②2H2(g)+O2(g)![]() 2H2O(g),K=2×1081;
2H2O(g),K=2×1081;
③2CO2(g)![]() 2CO(g)+O2(g),K=4×10-92
2CO(g)+O2(g),K=4×10-92
则常温下,NO、H2O、CO2这三个化合物分解放氧的倾向最大的是( )
A.① B.② C.③ D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温体积可变的密闭容器中发生反应:A(g)+B(g)![]() 2C(g) ΔH<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )
2C(g) ΔH<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )
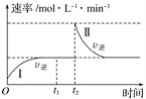
A.O~t2时,v正>v逆
B.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ
C.t2时刻改变的条件是向密闭容器中加C
D.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的ZnSO4和CuSO4的混合溶液中,逐滴加入1.5 mol·L1的Na2S溶液直至溶液中无沉淀产生,然后过滤。已知:Ksp(ZnS)=2.0×1022,Ksp(CuS)=1.3×1036。下列说法不正确的是
A.先生成CuS后生成ZnS沉淀,属于沉淀的转化
B.当ZnS沉淀完全时,溶液中![]() =6.5×1015
=6.5×1015
C.过滤得到的沉淀是CuS和ZnS的混合物
D.过滤后得到的溶液中仍有极少量的Cu2+和Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pNi= -lg c(Ni2+),常温下H2S的电离平衡常数:Kal=l. 3×10-7,Ka2=7. 1×10-15。常温下,向10 mL 0. 1 molL-1Ni(NO3)2溶液中滴加0.1 molL-1Na2S溶液,滴加过程中pNi与Na2S溶液体积的关系如图所示。下列说法正确的是

A.E、F、G三点中,F点对应溶液中水电离程度最大
B.常温下,Ksp(NiS) = 1×10-21
C.Na2S溶液中 c(S2- )+c(HS- )+c(H2S) =c(Na+)
D.Na2S溶液中,S2-第一步水解常数Kh1=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com