
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| N(HI)/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
| ||
| 2min |


科目:高中化学 来源: 题型:
| A、中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为l:l |
| B、pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
| C、0.1 mol?L-NaHC03溶液中:c(Na+)>c(HCO3-)>c(CO32一)>c(H2C03) |
| D、浓度均为0.1 mol/L的三种溶液:①CH3COOH溶液;②NaOH溶液;⑧CH3COONa溶液,溶液的PH ②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
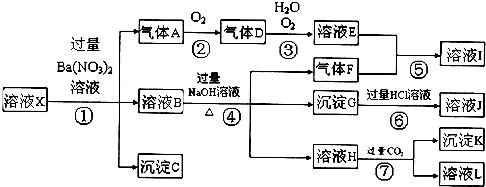
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学为了探究不同条件下铁钉的锈蚀情况,设计了如下实验:
某同学为了探究不同条件下铁钉的锈蚀情况,设计了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
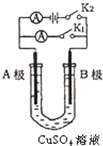 如图所示,U形管内盛有100mL的CuSO4溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的CuSO4溶液,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2F2+2H2O=4HF+O2 | ||||
| B、3NO2+H2O=2HNO3+NO | ||||
| C、2Na+2H2O=2NaOH+H2↑ | ||||
D、C+H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com