
下列物质的制备与工业生产相符的是
①NH3  NO
NO 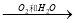 HNO3
HNO3
②浓HCl 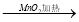 Cl2
Cl2  漂白粉
漂白粉
③MgCl2(aq) 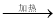 无水MgCl2
无水MgCl2  Mg
Mg
④饱和NaCl(aq) 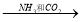 NaHCO3
NaHCO3 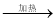 Na2CO3
Na2CO3
⑤铝土矿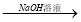 NaAlO2溶液
NaAlO2溶液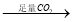 Al(OH)3
Al(OH)3 Al2O3
Al2O3  Al
Al
A.①④⑤ B.①③⑤ C.②③④ D.②④⑤
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
将 浓度为0.1 mol·L-1 HF
浓度为0.1 mol·L-1 HF 溶液加水不断稀释,下列各
溶液加水不断稀释,下列各 量始终保持增大的是( )
量始终保持增大的是( )
A.c(H+) B.Ka(HF)
C.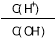 D.
D.
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:实验题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
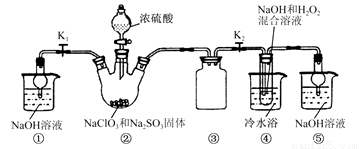
(1) 装置②中产生ClO2气体的化学方程式为 ;
装置④中制备NaClO2的化学方程式为 。
(2) 装置③的作用是 。
(3) 从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60 ℃干燥,得到成品。
实验II. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2?+4I?+4H+==2H2O+2I2+Cl?);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L?1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32?=2I?+S4O62?)。
(4) 达到滴定终点时的现象为 。
(5) 该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6) 在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
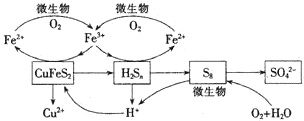 我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出.该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法.
我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出.该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com