
分析 (1)水溶液中或熔融状态下完全电离的电解质为强电解质,水溶液中和熔融状态下都不导电的化合物为非电解质;
(2)⑤0.1mol•L-1CH3COOH 加入等浓度、等体积的④0.1mol•L-1NH3.H2O,生成强电解质醋酸铵;
(3)碳酸根离子水解生成氢氧根离子溶液显碱性,设计实验有碳酸根离子时溶液显碱性,除去碳酸根离子后溶液不显碱性;
(4)用pH试纸测pH值计算水解产生的氢氧根离子的浓度;
解答 解:(1)③0.1mol•L-1Na2CO3 水溶液中完全电离属于强电解质,⑥BaSO4熔融状态下完全电离属于强电解质,②SO2 水溶液中导电是因为生成了电解质亚硫酸,二氧化硫不能电离属于非电解质,
故答案为:③⑥;②;
(2)⑤0.1mol•L-1CH3COOH 加入等浓度、等体积的④0.1mol•L-1NH3.H2O,生成强电解质醋酸铵完全电离,溶液离子浓度增大,导电性增强,
故答案为:增强;
(3)碳酸根离子水解生成氢氧根离子溶液显碱性,其水解方程式为:CO32-+H2O?HCO3-+OH-,设计实验有碳酸根离子时溶液显碱性,除去碳酸根离子后溶液不显碱性,其操作为:取0.1mol/L的纯碱溶液少许于试管中,滴入几滴酚酞,溶液呈红色,再滴加足量BaCl2溶液,若溶液红色退去,则证明纯碱溶液显碱性的原因是CO32-水解;
故答案为:CO32-+H2O?HCO3-+OH-;取0.1mol/L的纯碱溶液少许于试管中,滴入几滴酚酞,溶液呈红色,再滴加足量BaCl2溶液,若溶液红色退去,则证明纯碱溶液显碱性的原因是CO32-水解;
(4)用pH试纸测pH值计算水解产生的氢氧根离子的浓度,其操作为:用pH试纸测0.1mol/L的Na2CO3溶液的pH,若pH<12,则证明水解的CO32-不超过其总量的10%,则该同学观点正确;若pH>12,则该观点不正确,
故答案为:用pH试纸(或pH计)测常温下0.1mol•L-1纯碱溶液的pH,若pH<12,则该同学观点正确;若pH>12,则该观点不正确;
点评 本题考查了弱电解质的电离平衡、盐的水解原理及其影响,题目难度中等,明确影响电离平衡、盐的水解的因素为解答关键,注意掌握性质实验方案设计的原则,试题培养了学生的分析、理解能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5mol•L-1醋酸 | D. | 0.5 mol•L-1氯化铵溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3的水解:SO32-+2H2O?H2SO3+2OH- | |
| B. | NaHCO3的电离:NaHCO3?Na ++H++CO32- | |
| C. | 钢铁发生吸氧腐蚀的负极反应式:4OH-+4e-=H2O+O2↑ | |
| D. | 用惰性电极电解饱和食盐水时,阳极的电极反应式:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )
白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )| A. | 化合物A的分子式为P2O3 | |
| B. | 化合物A是磷酸的酸酐 | |
| C. | 化合物A是磷元素的最高价氧化物 | |
| D. | 化合物A中每个原子最外层都达到8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
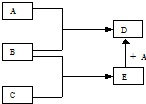 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示.
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
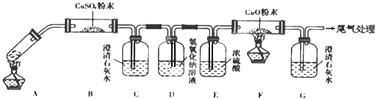
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可使单位体积内活化分子数增多,反应速率加快 | |
| B. | 已知:C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3 kJ/mol,△S=+133.7 kJ/mol则该反应在低温下能自发进行 | |
| C. | 将FeCl3的水溶液加热蒸干可得到FeCl3固体 | |
| D. | 使用催化剂可降低反应的△H和反应的活化能,从而提高化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com