
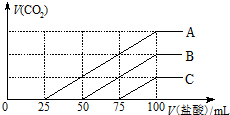
 浓度相同的NaOH溶液各100ml 倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐渐加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100ml 倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐渐加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示.下列判断正确的是( )| A. | 原NaOH溶液的浓度为0.2mol/L | |
| B. | B烧杯中通入CO2体积为448ml | |
| C. | 通入CO2后,不能确定A烧杯中的溶质 | |
| D. | 通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=2:1 |
分析 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,可发生CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,反应后溶液可能有四种情况,①NaOH和Na2CO3,②Na2CO3,③Na2CO3和NaHCO3,④全部为NaHCO3,加入盐酸,首先发生NaOH+HCl=NaCl+H2O、其次发生Na2CO3+HCl=NaHCO3+NaCl,最后发生产生气体NaHCO3+HCl=NaCl+CO2↑+H2O,结合产生气体前后消耗盐酸的体积大小进行判断.
解答 解:浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,可发生CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,反应后溶液可能有四种情况,①NaOH和Na2CO3,②Na2CO3,③Na2CO3和NaHCO3,④全部为NaHCO3,加入盐酸,首先发生NaOH+HCl=NaCl+H2O、其次发生Na2CO3+HCl=NaHCO3+NaCl,最后发生产生气体NaHCO3+HCl=NaCl+CO2↑+H2O,
A.由图可知,加入100mLHCl时,产生二氧化碳的体积最大,说明此时溶液中溶质为NaCl,根据氯离子、钠离子守恒可得n(NaOH)=n(NaCl)=n(HCl)=0.1L×0.2mol/L=0.02mol,故原溶液中氢氧化钠的物质的量浓度=$\frac{0.02mol}{0.1L}$=0.2mol/L,故A正确;
B.曲线B中,从50mL~100mL发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,生成二氧化碳最大时,该阶段消耗盐酸为100mL-50mL=50mL,由方程式可知n(CO2)=n(HCl)=0.05L×0.2mol/L=0.01mol,V(CO2)=0.01mol×22.4L/mol=0.224L=224mL,根据碳原子守恒可知该反应生成的二氧化碳体积等于通入的二氧化碳的体积,即通入的二氧化碳为224mL,故B错误;
C.由图象可知,生成气体前后消耗盐酸的体积比为1:3,说明NaHCO3与HCl反应消耗多,则A中溶质应为Na2CO3和NaHCO3,可确定,故C错误;
D.曲线C中,从75mL~100mL发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,该阶段消耗盐酸为25mL,若NaHCO3完全由反应Na2CO3+HCl=NaHCO3+NaCl转化得到,根据方程式可知,需要消耗盐酸25mL,而产生二氧化碳时消耗盐酸为75mL,大于25mL,说明0mL~75mL阶段盐酸还与氢氧化钠反应,即原NaOH溶液中通入CO2后,所得溶液中的溶质成分NaOH、Na2CO3,由方程式可知n(CO2)=n(HCl)=0.025L×0.2mol/L=0.005mol,根据原子守恒可知n(Na2CO3)=n(CO2)=0.005mol,根据钠离子守恒n(NaOH)=0.02mol-2×0.005mol=0.01mol,故原NaOH溶液中通入CO2后,所得溶液中的n(NaOH):n(Na2CO3)=0.01mol:0.005mol=2:1,故D正确;
故选AD.
点评 本题考查混合物的有关计算、化学反应图象等,为高频考点,侧重于学生的分析能力和计算能力的考查,根据图中盐酸的体积判断产生二氧化碳前CO2与NaOH反应过程是解题关键,注意守恒思想与方程式的运用,难度中等.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
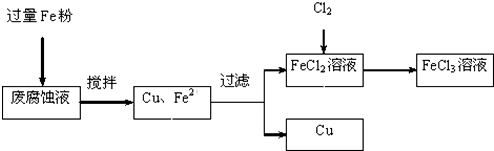
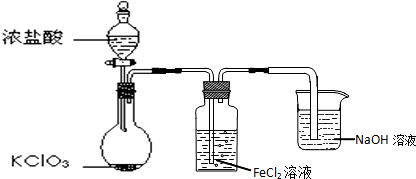
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 营养平衡、合理用药是保证人体健康和生活质量的重要途径.
营养平衡、合理用药是保证人体健康和生活质量的重要途径.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 实验目的 |
| A | 沿玻璃棒将蒸馏水缓慢倒入盛有浓硫酸的烧杯中,边加边搅拌 | 稀释浓硫酸 |
| B | 测定相同浓度的Na2SO4和Na2SiO3溶液的pH值 | 比较硫和硅的非金属性强弱 |
| C | 将铁的氧化物溶于过量稀盐酸中,再滴加几滴紫红色KMnO4溶液 | 判断某铁的氧化物是否含有Fe2+ |
| D | 用装有双氧水的碱式滴定管,采用淀粉溶液作为指示剂,滴定NaCl和NaI混合溶液 | 测定NaI的含量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Mg粉中混有的Al粉:加入足量的氨水,过滤 | |
| B. | 除去BaCO3固体中混有的BaSO4:加入过量盐酸后,过滤、洗涤 | |
| C. | 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 | |
| D. | 从I2的四氯化碳溶液中分离出I2:分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
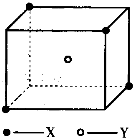 某晶体的晶胞结构如图所示.X(•)位于立方体顶点,Y(○)位于立方体中心.试分析:
某晶体的晶胞结构如图所示.X(•)位于立方体顶点,Y(○)位于立方体中心.试分析:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com