
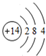
 ③F-,④
③F-,④ 其核外电子数相同的是( )
其核外电子数相同的是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
分析 根据质子数或原子序数与电子数的关系计算电子数,阳离子的核外电子数=质子数-所带电荷数,阴离子核外电子数=质子数+所带电荷数;结构示意图中弧线上的数字表示该层含有的电子数,核外电子数等于各层电子数之和.
解答 解:①13Al3+,质子数是13,原子的电子数是13,由原子失去3个电子变成阳离子,所以该阳离子有10个电子;
②根据离子结构示意图 知,核外电子数为2+8=10;
知,核外电子数为2+8=10;
③F-是由F原子得1个电子生成的,F原子有9个电子,所以F-有10个电子;
④根据电子式 知,该离子最外层8个电子,氯原子为17号元素,内层有10个电子,所以该离子共有17+1=18个电子;
知,该离子最外层8个电子,氯原子为17号元素,内层有10个电子,所以该离子共有17+1=18个电子;
故选:A.
点评 本题考原子结构示意图、离子中微粒之间的关系,注意理解离子中质子数、核外电子数、电荷之间的关系,注意无论原子变成离子,还是离子变成原子,变化的是核外电子数,不变的是核内质子数和核电荷数,题目难度不大.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K>Na>Li | B. | Na+>Mg2+>Al3+ | C. | Mg2+>Na+>F- | D. | S2->Cl->F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 取代、加成、取代 | B. | 还原、消去、加成 | C. | 氧化、加成、消去 | D. | 氧化、取代、取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
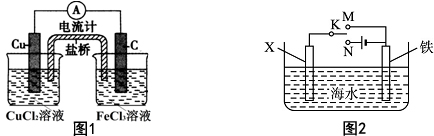
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com