
今有HA、H2B两种弱酸,有如下关系:H2B+A-=HB-+HA B2-+HA=HB-+A-则下列说法正确的是:
A、H2B的电离方程式为:H2B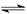 2H+ + B2-
2H+ + B2-
B、结合质子能力由强到弱的顺序为:B2->A->HB-
C、等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强
D、等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者
科目:高中化学 来源:2014届辽宁省丹东市高二上学期期末考试化学试卷(解析版) 题型:选择题
今有HA、H2B两种弱酸,有如下关系:H2B+A-=HB-+HA B2-+HA=HB-+A-则下列说法正确的是:
A、H2B的电离方程式为:H2B 2H+ + B2-
2H+ + B2-
B、结合质子能力由强到弱的顺序为:B2->A->HB-
C、等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强
D、等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
研究化学反应实质,探究反应规律,是提高我们化学素养的有效手段,其中“以强制弱”的规律是我们所熟知的。
(1)今有HA、H2B两种弱酸,有如下关系:H2B(少量)+A-=== HB-+HA ,则在A-、HB-、B2-离子中,最易结合质子的是 ;
(2)酸性强弱除了与物质本身属性有关外,还和溶剂有关,如CH3COOH与HF在液氨中受NH3影响可发生完全电离。那么在液氨中反应:CH3COONa + HCl == NaCl + CH3COOH 能否发生,为什么? ;
(3)铝铵矾,其主要化学成分为十二水硫酸铝铵,向该盐的溶液中逐滴加入NaOH溶液,产生的现象有:
①溶液中出现白色沉淀;
②有刺激性气味的气体放出;
③白色沉淀量逐渐增多;
④白色沉淀逐渐消失;
请排出以上各种现象由先到后出现的正确顺序(用序号回答) ;
(4)在氧化还原反应中,也有“以强制弱”的类似规律。已知MnO2在酸性溶液中易被还原成Mn2+, MnO2、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2 + 6FeI2 = 2FeCl3 +4FeI3 B.Cl2 + FeI2=FeCl2 +I2
C.MnO2+4HCl = MnCl2 +Cl2↑+2H2O D.2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com