
| A.氯化铁溶液和氯化铜溶液 |
| B.硫酸钠溶液和氯化钠溶液 |
| C.氯化铝溶液和氢氧化钠溶液 |
| D.硫酸溶液和碳酸钠溶液 |
科目:高中化学 来源:不详 题型:实验题
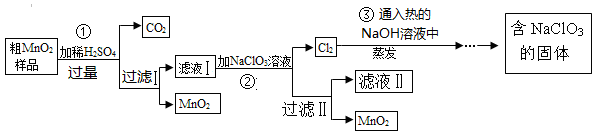
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
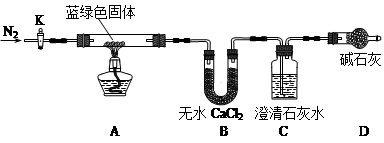
| 溶解度(S)/g | 溶度积(Ksp) | 摩尔质量(M)/g·mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
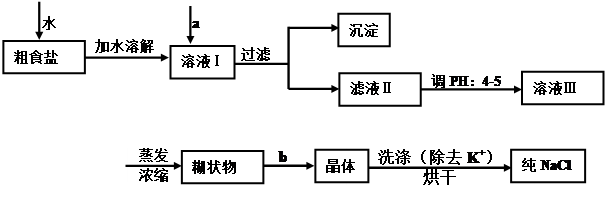
| A.定容完毕后,盖塞,摇匀,再将容量瓶置于实验台上,发现液面低于刻度线,再添加蒸馏水至刻度线。 | |
| B.未将洗涤烧杯内壁的溶液转入容量瓶。 | C.定容时,俯视刻度线。 |
| D.转移溶液之前,容量瓶内有少量蒸馏水。 E、称量时,天平指针指向左盘。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中,检验气体中含有乙烯 |
| B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 |
| C.淀粉溶液和稀H2SO4混合加热,加入新制Cu(OH)2悬浊液加热至沸腾,检验淀粉水解产物有还原性 |
| D.利用如图装置并根据有关实验现象能推知酸性强弱:CH3COOH>C6H5OH>H2CO3 |
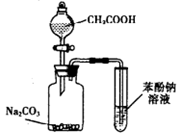
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 NH2COONH4(s) + Q (Q > 0 )
NH2COONH4(s) + Q (Q > 0 ) 
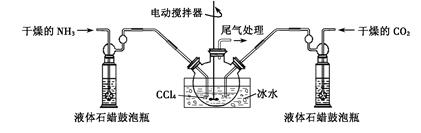
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用盐析法分离NaCl溶液和淀粉胶体 |
| B.除去苯中少量苯酚,向混合物中加人足量的NaOH溶液后过滤 |
| C.加足量的稀盐酸可除去BaCO3固体中少量的BaSO4 |
| D.向硝酸银稀溶液中逐滴加人稀氨水至白色沉淀恰好溶解,即得银氨溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com