
以下进行性质比较的实验设计,合理的是
A.用NaOH溶液与FeCl3溶液制备Fe(OH)3胶体
B.比较氯、溴非金属性:氯气通入溴化钠溶液中
C.将混有SO2的CO2通入NaOH溶液中除去SO2
D.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol·L-1NaOH溶液中
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g)  2C(g),
2C(g),
2 min后达到平衡,生成0.4 mol C,测得混合气体共3.4 mol,则下列结果正确的是
A.平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B.x值等于3
C.A的转化率为20%
D.B的平均反应速率为0.4 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
[化学——选修三:物质结构与性质](15分)
2011年3月11日日本发生了9.0级强地震。福岛第一核电站1号机组12日下午发生氢气爆炸。随后在爆炸核电站周围检测到的放射性物质有碘-131和铯—137,碘-131一旦被人体吸入,可能会引发甲状腺疾病。日本政府计划向核电站附近居民发放防止碘-131辐射的药物碘片。
(1)Cs(铯)的最外层电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种元素A、B、C的电离能如下表:

那么三种元素C的元素符号为____________,形成其单质晶体的化学键类型__________。
(2)F、Cl、Br与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别是________、________。与碘同主族的氯具有较高的活泼性,能够形成大量的含氯化合物,如金属氯化物,非金属氯化物等。BCl3是一种非金属氯化物,该物质分子中B—Cl键的键角为________。基态溴原子的简化电子排布式为 _____ 。
(3)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由高到低的顺序为_______ __。
(4)测定气态氟化氢分子量总大于20,你认为可能的原因为 。
(5)碘—131是碘单质,其晶胞结构如下图甲所示,该晶胞中含有________个I2分子;KI的晶胞结构如下图乙所示,每个K+紧邻________个I-。
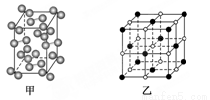
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④(NH4)2S
A.③④ B.②③④ C.①③④ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三上学期期中理综化学试卷(解析版) 题型:填空题
(16分)已知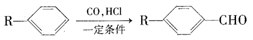
为合成某种液晶材料的中间体M,有人提出如下不同的合成路径:

(1)常温下,下列物质能与A发生反应的有________(填序号)。
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+ 溶液
(2)M中官能团的名称是_______,由C→B的反应类型为__________。
(3)由A催化加氢生成M的过程中,可能有中间产物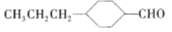 和______(写结构简式)生成。
和______(写结构简式)生成。
(4)检验B中是否含有C可选用的试剂是___________(任写一种名称)。
(5)物质B也可以由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为_______。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(9分) 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成:

请回答:
(1)B→C的反应类型是______ ______。D中所含的官能团名称是 。
(2)下列关于化合物G的说法不正确的是__ ___。
a.分子式是C9H6O3
b.不能与金属钠反应
c.分子中含有4种官能团
d.能与液溴反应
e.1 mol G最多能和4mol氢气反应
(3)写出A与银氨溶液反应的化学方程式 。
(4)写出D→E的化学方程式__________________ ___________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH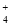 )> c(SO
)> c(SO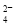 )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO )+c(HCO
)+c(HCO )+c(OH-)
)+c(OH-)
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO )
)
D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c(CH3COO-)>c (Na+)>c(H+)> c (OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
【化学——选修3:物质结构与性质】(15分)
(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为 ,CO有多种等电子体,其中常见的一种分子是 。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有 个δ键,C原子的杂化方式为 。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是 ,形成的化学键是 。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
写出A原子的电子排布图 ,Al原子的第一电离能 (填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是 。
(3)下图是一种镍(Ni)镧(La)合金储氢后的晶胞结构图。该合金储氢后,含0.5mol Ni的合金可吸附氢气的体积(标况)为 。
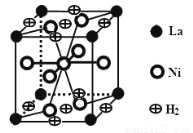
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
钠铝合金(常温液态)可作为核反应堆的载热介质。下列说法错误的是
A.该合金的熔点低于金属钠的熔点
B.若将钠铝合金投入水中得到无色溶液且无固体剩余,则n(Na)≥n(Al)
C.若将钠铝合金投入FeCl3溶液中有Fe(OH)3沉淀生成
D.等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com