


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
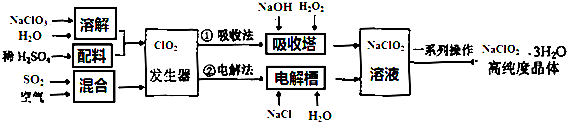
| A、发生器中鼓入空气的作用是将SO2氧化成SO3 |
| B、吸收塔中加入的H2O2可以用Na2O2代替 |
| C、电解槽中阴极的反应为ClO2+e-=ClO2- |
| D、一系列操作中必不可少的步骤是重结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
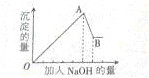 有一无色溶液,可能含有Fe3+,Al3+,Mg2+,Cu2+,NH4+,K+,CO32-,SO42-,NO3-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
有一无色溶液,可能含有Fe3+,Al3+,Mg2+,Cu2+,NH4+,K+,CO32-,SO42-,NO3-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:| 主要实验内容 | 现 象 | |
| ① | 焰色反应(透过蓝色钴玻璃) | 紫色火焰 |
| ② | 先加入稀盐酸后加BaCl2溶液 | 无气体产生,但是出现白色沉淀 |
| ③ | 逐滴加入NaOH溶液至过量 | 生成白色沉淀的量与加入NaOH的量的关系如下图所示 |
| ④ | 加入足量Na2O2粉末 | 生成无色无味气体,白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
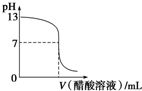 常温下,向10mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,向10mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )| A、pH<7时,溶液中:c(CH3COO-)<c(Na+) |
| B、7<pH<13时,溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、pH=7时,所加醋酸溶液的体积大于10 mL |
| D、继续滴加0.1 mol?L-1醋酸溶液,溶液pH可以变为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q2=2 Q1 |
| B、Q2<Q1<197 kJ |
| C、Q2=Q1<197 kJ |
| D、以上均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
 | 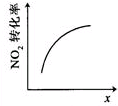 |  | 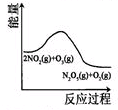 |
| t1时仅加入催化剂,平 衡向正方向移动 | 达平衡时,仅改变x, 则x为c(O2) | 从反应开始达平衡气体浓度变化 | 升高温度,平衡常数 减小 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com