
分析 (1)根据n=$\frac{N}{{N}_{A}}$计算9.03×1022个原子的物质的量,结合1个水分子含有原子数目计算水的物质的量;
(2)根据n=$\frac{V}{{V}_{m}}$、M=$\frac{m}{n}$计算出该气体的摩尔质量;设水的体积为1L,则该气体体积为448L,根据m=nM=$\frac{V}{{V}_{m}}$M计算出该气体的质量,从而可知该溶液质量,再根据ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算出所得溶液的质量分数;根据c=$\frac{1000ρω}{M}$计算出该溶液的物质的量浓度;
(3)据NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,可知H元素化合价由-1价、+1价变为0价,再结合转移电子守恒书写化学方程式;依据方程式及化合价变化计算转移电子数目;
(4)由方程式可知,当3molNH3参加反应时,有2molNH3被氧化,根据方程式计算.
解答 解:(1)9.03×1022个原子的物质的量为$\frac{9.03×1{0}^{22}}{6.02×1{0}^{23}}$=0.15mol,1个水分子含有3个原子,故水的物质的量为$\frac{0.15mol}{3}$=0.05mol,故答案为:0.05;
(2)标准状况下,560mL某气体A的质量为0.75g,该气体的物质的量为:$\frac{0.56L}{22.4L/mol}$=0.025mol,其摩尔质量为:M=$\frac{0.75g}{0.025mol}$=30g/mol;
该气体在水中的溶解度为448,设水的体积为1L,则1L水中最多溶解该气体的体积为448L,标准状况下448L气体的物质的量为:$\frac{448L}{22.4L/mol}$=20mol,其质量为:30g/mol×20mol=600g,1L水的质量约为1000g,则得到的饱和溶液中溶质A的质量分数为:$\frac{600g}{1000g+600g}$×100%=37.5%;
若测得该溶液密度为1.24g/cm3,则该溶液的物质的量浓度为:c=$\frac{1000ρω}{M}$=$\frac{1000×1.24×37.5%}{30}$mol/L=15.5mol/L,
故答案为:30g/mol;37.5%;15.5mol/L;
(3)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,所以NaBH4与H2O发生归中反应,生成NaBO2和氢气,H元素化合价由-1价、+1价变为0价,依据得失电子守恒可知:NaBH4的系数为1,H2O的系数为2,依据原子个数守恒,反应方程式:NaBH4+2H2O=NaBO2+4H2↑;
反应中NaBH4中的-1价的氢升高到氢气中的0价,消耗1molNaBH4,失去4mol电子;
故答案为:NaBH4+2H2O=NaBO2+4H2↑;4mol;
(4)由方程式可知,当3molNH3参加反应时,有2molNH3被氧化,消耗Cl21.5mol则
3Cl2+8NH3=6NH4Cl+N2 被氧化NH3
3 2
1.5mol n
$\frac{3}{1.5}=\frac{2}{n}$,解得n=1mol,
则被氧化的NH3在标准状况下的体积为1mol×22.4L/mol=22.4L,
故答案为:22.4.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度与溶质质量分数的关系为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
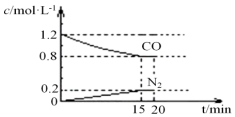 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | B. | 氧化性I2>KClO3 | ||
| C. | 还原性KClO3>I2 | D. | 还原剂为I2,氧化剂为Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80g硝酸铵含有氮原子数为2NA | |
| B. | 1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 标准状况下,11.2L蒸馏水所含分子数为0.5NA | |
| D. | 在铜与硫的反应中,1mol铜失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C与CO2能继续反应 | B. | 与澄清石灰水反应产生白色沉淀 | ||
| C. | 与足量盐酸反应放出气体 | D. | 受热易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+3OH-═Al(OH)3 | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-3e-═Fe3+ | |
| D. | 由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解500mL硝酸银溶液,当消耗铜电极32 g时,电解池溶液中pH=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL18.4mol•L-1浓硫酸与足量锌反应,转移电子数为0.184NA | |
| B. | 0.1 mol24Mg18O晶体中所含中子总数为2.0 NA | |
| C. | 在标准状况下,2.8g N2和2.24L CO所含电子数均为1.4NA | |
| D. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com