
| A. | LiH是离子晶体 | B. | LiH的水溶液呈酸性 | ||
| C. | LiH是一种氧化剂 | D. | LiH中H-半径大于Li+半径 |
分析 A.LiH中存在离子键;
B.氢化锂跟水反应能生成氢气,方程式LiH+H2O=LiOH+H2↑;
C.根据H元素的化合价分析;
D.电子排布相同的离子,原子序数越大,离子半径越小.
解答 解:A.LiH中锂离子与氢离子之间以离子键结合,属于离子晶体,故A正确;
B.氢化锂跟水反应能生成氢气,方程式LiH+H2O=LiOH+H2↑,所以LiH的水溶液呈碱性,故B错误;
C.LiH中H元素的化合价为-1价,具有最低价,具有还原性,所以LiH是一种还原剂,故C错误;
D.电子排布相同的离子,原子序数越大,离子半径越小,所以LiH中H-半径大于Li+半径,故D正确.
故选BC.
点评 本题考查了化学键、氧化还原反应、离子半径的比较等,题目难度不大,侧重于基础知识的考查,注意相关知识的积累.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:实验题
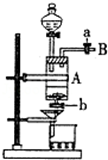 三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.
三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
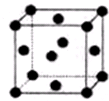 X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
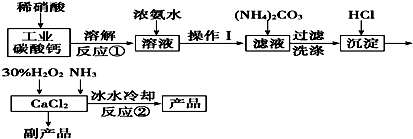
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石蜡油分解产生的气态产物中不含有不饱和烃 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 油脂是种高级脂肪酸甘油酯,其中植物油通过氢化可以变成脂肪 | |
| D. | 苯与浓硝酸、浓硫酸混合,加强热以制备硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口下沿处 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 能用CCl4从碘水中萃取碘是由于CCl4与H2O互不相溶且碘在CCl4中溶解度比在水中的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com