
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分 BaCO3(含 Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备 BaCl2·2H2O 的流程如下:
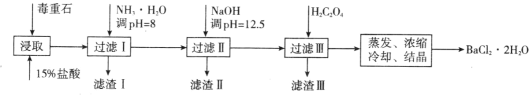
(1)毒重石用盐酸浸取前需充分研磨,目的是_______。实验室用 37%的盐酸配制 15%的盐酸,除量筒外还需使用下列仪器中的_______(填标号)。
a 烧杯 b 容量瓶 c 玻璃棒 d 滴定管
(2)
Ca2+ | Mg2 + | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.2 |
流程中,滤渣Ⅱ中含_______(填化学式)。加入 H2C2O4 时应避免过量,原因是_______。 [已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)利用间接酸碱滴定法可测定 Ba2+的含量,实验分两步进行。已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取 xmL 一定浓度的 Na2CrO4 溶液与锥形瓶中,加入酸碱指示剂,用 b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为 V0 mL。
步骤Ⅱ:移取 y mLBaCl2 溶液于锥形瓶中,加入 x mL 与步骤Ⅰ相同浓度的 Na2CrO4 溶液,待 Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为 V1 mL。滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的_______(填“上方”或“下方”)。BaCl2 溶液的浓度为___________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将_______(填“偏大”或“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
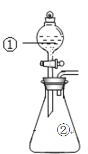
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铁片 | 产生红棕色气体 |
C. | 氯化铵溶液 | 氢氧化镁沉淀 | 白色沉淀溶解 |
D. | 碳酸氢钠溶液 | 苯酚钠溶液 | 溶液变浑浊 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质的溶液:①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小比较为____________(用序号表示,下同)。
(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为___________,经测定溶液中c(CH3COO-)为1.4×10-3 mol/L,此温度下醋酸的电离常数Ka=____________,温度升高,Ka将_____(填“变大”“不变”或“变小”,下同),加入少量CH3COONa后c(H+)______,Ka______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如图:
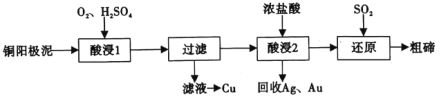
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为___。
(2)“酸浸1”过程中,为加快浸出速率,可采取的方法有___(填1种)。“酸浸2”时温度过高会使Te的浸出率降低,原因是___。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为___;“还原”过程中,发生反应的离子方程式为___。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为___。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是___。
(5)常温下,向lmol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=___。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是( )
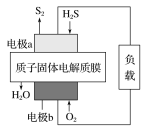
A.电极a为电池的负极
B.电极b上的电极反应式为O2+4H++4e-===2H2O
C.若电路中通过2 mol电子,则电池内部释放632 kJ热能
D.若有17 g H2S参与反应,则会有1 mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,体积相同、浓度均为1.0 mol·L–1的HX溶液、HY溶液,分别加水稀释,稀释后溶液的pH随稀释倍数的对数的变化如图所示,下列叙述正确的是( )
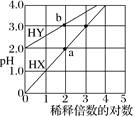
A.HX是强酸,溶液每稀释10倍,pH始终增大1
B.常温下HY的电离常数约为1.0×10–4
C.溶液中水的电离程度:a点大于b点
D.消耗同浓度的NaOH溶液体积:a点大于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用钛白渣[主要成分为FeSO4,还含有少量Fe2(SO4)3、MgSO4及TiOSO4]为主要原料生产氧化铁黄(FeOOH)的一种工艺流程如下:
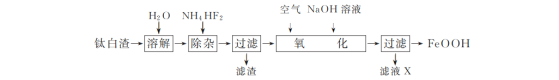
(1)“溶解”时,TiOSO4发生水解生成难溶于水的H2TiO3,反应的化学方程式为________。
(2)“除杂”时,加入NH4HF2固体的作用是________。
(3)“氧化”时,Fe2+生成FeOOH的离子方程式是________。
(4)滤液X中主要含有的阳离子是________(填化学式)。
(5)实验测得反应溶液的pH、温度对氧化铁黄产率的影响如图所示。

①反应温度宜选择________。
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致氧化铁黄产率较低,其可能原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β硝基苯乙烯是一种黄色针状晶体,熔点55~58 ℃,沸点250~260 ℃,不溶于水,易溶于乙酸、二氯甲烷等有机溶剂。制备原理如下:
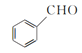 +CH3NO2
+CH3NO2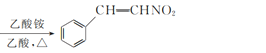
(1) 反应装置冷凝管中水应从________(填“a”或“b”)处通入。
(2)制备过程中,需在搅拌下滴加苯甲醛,控制滴加速率反应6 h,加热温度在110 ℃左右,那么采用的加热方法为________,如温度过高时,则可以采取________措施。

(3)反应混合液需加入一定量的水才析出黄色絮状物,加水的作用是________。
(4)过滤后用95%乙醇重结晶,再进行抽滤可获得黄色棱形晶体。抽滤装置所包含的仪器除减压系统外还有布氏漏斗和________(填仪器名称)。
(5)实验中使用恒压滴液漏斗的优点是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com