在标准状况下,10g CO2 和N2的混合气体的体积为6.72L.求此混合气体中CO2和N2的体积各为多少?
【答案】
分析:混合气体的物质的量为:n=
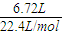
=0.3mol,根据质量之和和物质的量之和列式计算.
解答:解:n(CO
2)+n(N
2)=

=0.3mol,
n(CO
2)×44g/mol+n(N
2)×28g/mol,
解之得:n(CO
2)=0.1 mol,n(N
2)=0.2 mol,
则:V(CO
2)=0.1mol×22.4L/mol=2.24L,
V(N
2)=0.2mol×22.4L/mol=4.48L,
答:此混合气体中CO
2和N
2的体积各为2.24L、4.48L.
点评:本题考查物质的量的相关计算,题目难度不大,注意相关物理量计算公式的运用.

 阅读快车系列答案
阅读快车系列答案