
科目:高中化学 来源:不详 题型:单选题
| A.上述反应均属于氧化还原反应 | B.该厂可同时建硫酸厂和炼铁厂 |
| C.该厂的原料除富铜矿外,还需空气和硅石 | D.反应④转移12e- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定有Fe2+,一定没有Fe3+、Mg2+ |
| B.一定有Fe3+存在,一定没有Fe2+、Mg2+ |
| C.一定有Fe3+,可能有Fe2+,一定没有Mg2+ |
| D.一定有Fe2+,可能有Mg2+,一定没有Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.裂纹处尘埃多,起催化作用? |
| B.裂纹里面含水分? |
| C.裂纹处铁的表面积大,反应快? |
| D.原裂纹处的Fe2O3与盐酸反应,生成可溶的FeCl3? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2∶1 | B.1∶2? |
| C.1∶3 | D.1∶4? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
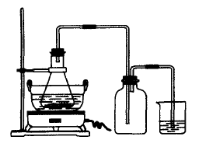
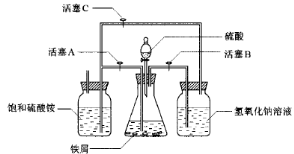
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 (1)反应后生成铜多少克?
(1)反应后生成铜多少克? (2)加入铁粉前Fe2(SO4)3物质的量浓度。
(2)加入铁粉前Fe2(SO4)3物质的量浓度。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com