
【题目】化学与生产、生活、社会密切相关。下列叙述错误的是( )
A.还原铁粉能用作食品包装袋中的抗氧化剂
B.中国华为自主研发的5G芯片巴龙5000的主要材料是SiO2
C.快餐盒用生物质材料“玉米塑料”(主要成分为可降解聚乳酸)可以减少白色污染
D.制冷压缩机中的氨是制冷剂
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】由N、B等元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅的制造;由第二周期元素组成的与BCl3互为等电子体的阴离子为_______(填离子符号,填一个)。
(2)氨硼烷(H3N→BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料.
①H3N→BH3中B原子的外围电子排布图_________。
②Ti(BH4)3由TiCl3和LiBH4反应制得,写出该制备反应的化学方程式____;基态Ti3+的成对电子有___对,BH4-的立体构型是____;Ti(BH4)3所含化学键的类型有____;
③氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3;与上述化学方程式有关的叙述不正确的是 _____________
A.氨硼烷中存在配位键
B.第一电离能:N>O>C>B
C.反应前后碳原子的轨道杂化类型不变
D.CH4、H2O、CO2都是非极性分子
(3)磷化硼(BP)是受到高度关注的耐磨材料,如图1为磷化硼晶胞;
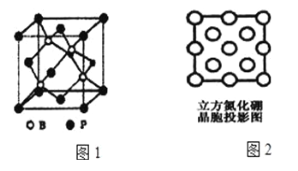
①晶体中P原子填在B原子所围成的____空隙中。
②晶体中B原子周围最近且相等的B原子有____个。
(4)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________。图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置______。其中“●”代表B原子,“×”代表N原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在氧气里充分燃烧,生成的CO2和H2O的物质的量之比为1∶1,由此可以得出该有机物( )
A.分子中肯定只含C、H两种元素
B.分子中C和H的个数比为1∶2
C.分子中肯定含有氧原子
D.分子中C、H、O的个数比为1∶2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②  ③
③ ④C2H2 ⑤N2H4 ⑥C6H6
④C2H2 ⑤N2H4 ⑥C6H6
A. ①②③ B. ①②⑥ C. ②③⑤ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是________(元素符号)。
(2)写出元素溴的基态原子的简化电子排布式_____________________,写出⑩的价电子排布图_____________________________________。
(3)某元素⑦的原子核外最外层电子的成对电子为________对。
(4)元素④的氢化物的分子构型为________,中心原子的杂化形式为________。
(5)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“⑧”为________(填元素符号);其中电负性最大的是________(填元素符号)。

(6)⑩的基态原子有____种能量不同的电子;如图___(填“甲”、“乙”或“丙”)表示的是⑩晶体中微粒的堆积方式。晶体中距离一个⑩原子最近的⑩原子有____个。若该晶体中一个晶胞的边长为a pm,则⑩晶体的密度为__________g.cm-3(写出含a的表达式,用NA表示阿伏加德罗常数的值,不需化简)。若⑩的原子半径为r,则⑩晶胞这种堆积模型的空间利用率为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________________,原因是________________________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在_____。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为___________________。六棱柱底边边长为acm,高为bcm,阿伏加德罗常数的值为NA,Zn的密度为_____________________________________g·cm-3(列出计算式)。
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】皂化反应实验的操作步骤如下:
①在小烧杯中加入约5 g 新鲜的动物脂肪(如牛油)和6 mL 95%的乙醇,微热使脂肪完全溶解;
②在①的混合液中加入6 mL 40%的氢氧化钠溶液,边搅拌边加热,直至反应液变成黄棕色黏稠状;
③用玻璃棒蘸取反应液,滴入装有热水的试管中,振荡,若无油滴浮在液面上,说明反应液中油脂已完全反应,否则要继续加热使之反应完全;
④在另一只烧杯中加入60 mL 热的饱和食盐水,把得到的反应液倒入食盐水中,搅拌,观察浮在液面上的固体物质,取出,用滤纸或纱布吸干,挤压成块,并与日常使用的肥皂比较去污能力的大小。
根据上面的实验步骤,请回答下列问题:
(1)加入乙醇的原因是_______________________________________。
(2)请写出硬脂酸甘油酯发生皂化反应的化学方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中的离子,能在溶液中大量共存的是( )
A.Na+、K+、SO42- 、NO3-B.K+、Ca2+、CO32- 、NO3-
C.Na+、NH4+、Cl- 、OH-D.Na+、H+ 、OH- 、Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 是原子序数依次增大的五种常
见元素,其中 A 是原子半径最小的元素,B 元素的一种核素可用于考古断代,D 元素的 s轨道和 p 轨道上的电子数相等且有2个未成对电子;E 是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。请用元素符号或化学式回答下列问题:
(1)A、B、C、D 四种元素中,电负性最大的是________,第一电离能最大的是________。
(2)化合物 CA3 的沸点比化合物 BA4 的高,其主要原因是___________________________ 。
(3)A、B 形成的化合物与氢氰酸(HCN)反应可得丙烯腈(H2CCHCN),丙烯腈分子中的碳原子轨道杂化类型是__________。
(4)由 C 元素形成的一种离子与 BD2 互为等电子体,该离子的结构式为__________。
(5)基态 E 原子的核外电子排布式为:_____________________________;D、E 形成的某种化合物的晶胞结构示意图如下,该晶体的化学式为__________。

(6)向 E 的硫酸盐溶液中通入过量的 CA3,可生成[E(CA3)4]2+,1 mol [E(CA3)4]2+中含有σ 键的数目约为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com