
| A. | 二氧化碳溶于水能部分电离,故二氧化碳属于电解质 | |
| B. | 硫酸钡难溶于水,但硫酸钡属于强电解质 | |
| C. | 氯化钠溶液在电流作用下完全电离成钠离子和氯离子 | |
| D. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 |
分析 A.二氧化碳自身不能电离,是非电解质;
B.硫酸钡溶于水的部分完全电离;
C.氯化钠在水分子作用下电离出钠离子和氯离子;
D.溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关.
解答 解:A.二氧化碳在水溶液中与水反应生成碳酸,碳酸电离出自由移动的离子导电,二氧化碳自身不能电离,二氧化碳是非电解质,故A错误;
B.硫酸钡难溶于水,但溶于水的部分完全电离,故硫酸钡为强电解质,故B正确;
C.氯化钠在水分子作用下电离出钠离子和氯离子,在电流作用下钠离子和氯离子发生定向移动,故C错误;
D.溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液强,故D错误,
故选B.
点评 本题考查电解质的概念、溶液导电原理、强弱电解质的判断等,难度不大.要注意硫酸钡难溶于水,但溶硫酸钡是强电解质.


科目:高中化学 来源: 题型:实验题
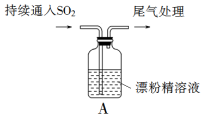 某化学兴趣小组的同学们对SO2通入漂粉精溶液的反应进行实验探究:
某化学兴趣小组的同学们对SO2通入漂粉精溶液的反应进行实验探究:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、N、O三种元素的氢化物稳定性依次减弱 | |
| B. | Mg、Al、Si三种元素的原子半径依次减小 | |
| C. | F、Cl、Br三种元素的非金属性依次减弱 | |
| D. | Li、Na、K三种元素的最高价氧化物对应水化物碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1mol/L氯化钠溶液 | B. | 75 mL 2mol/L氯化铵溶液 | ||
| C. | 150 mL 1mol/L氯化铁溶液 | D. | 75 mL 1mol/L氯化亚铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后向左侧烧杯中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(不考虑两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后向左侧烧杯中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(不考虑两球的浮力变化)( )| A. | 杠杆为导体或绝缘体时,均为A端高B端低 | |
| B. | 杠杆为导体或绝缘体时,均为A端低B端高 | |
| C. | 当杠杆为导体时,A端高B端低 | |
| D. | 当杠杆为导体时,A端低B端高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池工作时,电子由正极通过外电路流向负极 | |
| C. | 电池正极的电极反应式为2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| D. | 外电路中每通过0.1 mol电子,锌的质量理论上减少6.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al2(SO4)3═3Al3++2SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaHSO4═Na++H++SO42- | D. | K2MnO4═2K++MnO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com